Көміртегі - Carbon
 Графит (сол жақта) және алмас (оң жақта), көміртектің екі аллотропы | ||||||||||||||||||||||||||
| Көміртегі | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Аллотроптар | графит, гауһар, басқалар | |||||||||||||||||||||||||
| Сыртқы түрі |
| |||||||||||||||||||||||||
| Стандартты атомдық салмақ Ar, std(C) | [12.0096, 12.0116] дәстүрлі:12.011 | |||||||||||||||||||||||||
| Көміртегі периодтық кесте | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Атом нөмірі (З) | 6 | |||||||||||||||||||||||||
| Топ | 14 топ (көміртегі тобы) | |||||||||||||||||||||||||
| Кезең | кезең 2 | |||||||||||||||||||||||||
| Блок | p-блок | |||||||||||||||||||||||||
| Элемент категориясы | Металл емес реактивті, кейде а металлоид | |||||||||||||||||||||||||
| Электрондық конфигурация | [Ол ] 2с2 2б2 | |||||||||||||||||||||||||
| Бір қабықтағы электрондар | 2, 4 | |||||||||||||||||||||||||
| Физикалық қасиеттері | ||||||||||||||||||||||||||
| Кезең кезіндеSTP | қатты | |||||||||||||||||||||||||
| Сублимация нүктесі | 3915 К (3642 ° C, 6588 ° F) | |||||||||||||||||||||||||
| Тығыздығы (жақынr.t.) | аморфты: 1,8–2,1 г / см3[1] графит: 2,267 г / см3 алмас: 3,515 г / см3 | |||||||||||||||||||||||||
| Үш нүкте | 4600 К, 10,800 кПа[2][3] | |||||||||||||||||||||||||
| Балқу жылуы | 117кДж / моль | |||||||||||||||||||||||||
| Молярлық жылу сыйымдылығы | графит: 8.517 Дж / (моль · К) алмас: 6.155 Дж / (моль · К) | |||||||||||||||||||||||||
| Атомдық қасиеттері | ||||||||||||||||||||||||||
| Тотығу дәрежелері | −4, −3, −2, −1, 0, +1,[4] +2, +3,[5] +4[6] (жұмсақ) қышқыл оксид) | |||||||||||||||||||||||||
| Электр терістілігі | Полинг шкаласы: 2.55 | |||||||||||||||||||||||||
| Иондау энергиялары |
| |||||||||||||||||||||||||
| Ковалентті радиус | sp3: Кешкі 77 sp2: 73 сағ сп: 69кешкі | |||||||||||||||||||||||||
| Ван-дер-Ваальс радиусы | Кешкі 170 | |||||||||||||||||||||||||
| Басқа қасиеттері | ||||||||||||||||||||||||||
| Табиғи құбылыс | алғашқы | |||||||||||||||||||||||||
| Хрусталь құрылымы | графит:қарапайым алты бұрышты (қара) | |||||||||||||||||||||||||
| Хрусталь құрылымы | алмас:бетіне бағытталған алмас кубты (анық) | |||||||||||||||||||||||||
| Дыбыс жылдамдығы жіңішке таяқша | алмас: 18 350 м / с (20 ° C температурада) | |||||||||||||||||||||||||
| Термиялық кеңейту | гауһар: 0,8 (м / (м · К) (25 ° C температурада)[7] | |||||||||||||||||||||||||
| Жылу өткізгіштік | графит: 119–165 Вт / (м · К) алмас: 900–2300 Вт / (м · К) | |||||||||||||||||||||||||
| Электр кедергісі | графит: 7.837 µΩ · м[8] | |||||||||||||||||||||||||
| Магниттік тәртіп | диамагниттік[9] | |||||||||||||||||||||||||
| Магниттік сезімталдық | −5.9·10−6 (график.) см3/ моль[10] | |||||||||||||||||||||||||
| Янг модулі | алмас: 1050 ГПа[7] | |||||||||||||||||||||||||
| Ығысу модулі | алмас: 478 GPa[7] | |||||||||||||||||||||||||
| Жаппай модуль | алмас: 442 GPa[7] | |||||||||||||||||||||||||
| Пуассон қатынасы | алмас: 0,1[7] | |||||||||||||||||||||||||
| Мох қаттылығы | графит: 1-2 алмас: 10 | |||||||||||||||||||||||||
| CAS нөмірі |
| |||||||||||||||||||||||||
| Тарих | ||||||||||||||||||||||||||
| Ашу | Мысырлықтар және Шумерлер[11] (Б.з.д. 3750 ж.) | |||||||||||||||||||||||||
| Элементі ретінде танылды | Антуан Лавуазье[12] (1789) | |||||||||||||||||||||||||
| Негізгі көміртектің изотоптары | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
Көміртегі (бастап.) Латын: көмірсу «көмір») бұл а химиялық элемент бірге таңба C және атом нөмірі 6. Бұл металл емес және төрт валентті - төрт жасау электрондар қалыптастыруға қол жетімді ковалентті химиялық байланыстар. Ол периодтық жүйенің 14 тобына жатады.[13] Көміртегі жер қыртысының шамамен 0,025 пайызын ғана құрайды.[14] Үш изотоптар табиғи түрде пайда болады, 12C және 13C тұрақты, ал 14C Бұл радионуклид, а Жартылай ыдырау мерзімі шамамен 5 730 жыл.[15] Көміртегі - ежелгі заманнан бері белгілі бірнеше элементтер.[16]
Көміртегі - 15-ші Жер қыртысында ең көп кездесетін элемент, және массасы бойынша әлемдегі төртінші элемент кейін сутегі, гелий, және оттегі. Көміртектің көптігі, оның әртүрлілігі органикалық қосылыстар және оның ерекше қалыптасу қабілеті полимерлер әдетте кездесетін температурада Жер бұл элементтің қарапайым элемент ретінде қызмет етуіне мүмкіндік береді барлық белгілі өмір. Бұл екінші элемент адам денесі массасы бойынша (шамамен 18,5%) оттектен кейін.[17]
Көміртектің атомдары әртүрлі байланыста бола алады, нәтижесінде әртүрлі болады көміртектің аллотроптары. Ең жақсы белгілі аллотроптар графит, гауһар, және buckminsterfullerene.[18] The физикалық қасиеттері көміртегі аллотропты түрімен кеңінен өзгереді. Мысалы, графит мөлдір емес ал қара түсті алмаз өте жоғары мөлдір. Графит қағазда сызық қалыптастыру үшін жұмсақ (сондықтан оның атауы, бастап) Грек «γράφειν» етістігі «жазу» дегенді білдіреді, ал алмаз - бұл ең қиын белгілі табиғи материал. Графит жақсы электр өткізгіш ал гауһар төмен болса электр өткізгіштігі. Қалыпты жағдайда алмас, көміртекті нанотүтікшелер, және графен ең жоғарыға ие жылу өткізгіштік туралы барлық белгілі материалдар. Көміртекті аллотроптардың барлығы қалыпты жағдайда қатты күйде болады, графит ең көп болады термодинамикалық тұрақты стандартты температура мен қысым кезінде формасы. Олар химиялық төзімді және тіпті оттегімен әрекеттесу үшін жоғары температураны қажет етеді.
Ең ортақ тотығу дәрежесі көміртегі бейорганикалық қосылыстар +4, ал +2 табылған кезде көміртегі тотығы және өтпелі металл карбонил кешендер. Бейорганикалық көміртектің ірі көздері болып табылады әктастар, доломиттер және Көмір қышқыл газы, бірақ органикалық шөгінділерде едәуір мөлшерде болады көмір, шымтезек, май, және метан клатраты. Көміртектің көп мөлшерін құрайды қосылыстар, кез-келген басқа элементтерге қарағанда, осы уақытқа дейін сипатталған он миллионға жуық қосылыстармен,[19] және бұл сан стандартты жағдайда теориялық тұрғыдан мүмкін қосылыстар санының бір бөлігі ғана. Осы себепті көміртекті «элементтер патшасы» деп жиі атайды.[20]
Сипаттамалары

The көміртектің аллотроптары қосу графит, белгілі жұмсақ заттардың бірі және гауһар, ең қиын табиғи зат. Ол облигациялар басқа кішкентайлармен оңай атомдар көміртектің басқа атомдарын қосқанда және бірнеше тұрақты түзуге қабілетті ковалентті қолайлы көпвалентті атомдары бар байланыстар. Көміртегі он миллионға жуық қосылыстар түзетіні белгілі, бұл олардың көпшілігі химиялық қосылыстар.[19] Көміртектің ең жоғары мөлшері де бар сублимация барлық элементтердің нүктесі. At атмосфералық қысым ол сияқты балқу температурасы жоқ үш нүкте орналасқан 10.8±0,2 МПа және 4,600 ± 300 К (4,330 ± 300 ° C; 7,820 ± 540 ° F),[2][3] сондықтан ол шамамен 3900 К (3,630 ° C; 6,560 ° F) шамасында жоғарылайды.[21][22] Графит алмаздан гөрі стандартты жағдайда, әлдеқайда термодинамикалық тұрақты болғанымен, реакцияға қабілетті pi жүйесі шабуылға әлдеқайда осал. Мысалы, графитті ыстық концентрацияланған тотықтыруға болады азот қышқылы стандартты жағдайда мелли қышқылы, C6(CO2H)6, бұл үлкен құрылымды бұзу кезінде графиттің алты бұрышты бірліктерін сақтайды.[23]
Көміртегі температурасы шамамен 5800 К (5,530 ° C немесе 9,980 ° F) болатын көміртегі доғасында кішірейеді. Осылайша, оның аллотропиялық түріне қарамастан, көміртегі жоғары балқитын металдарға қарағанда жоғары температурада қатты күйінде қалады. вольфрам немесе рений. Термодинамикалық тұрғыдан бейім болса да тотығу, сияқты элементтерге қарағанда көміртек тотығуға тиімді әсер етеді темір және мыс, бұл бөлме температурасында әлсірететін агенттер.
Көміртек - күйі бар алтыншы элемент электронды конфигурация 1-ден22с22б2, оның ішінде төрт сыртқы электрон валенттік электрондар. Оның алғашқы төрт иондану энергиясы, яғни 1086,5, 2352,6, 4620,5 және 6222,7 кДж / моль, ауыр-14 элементтеріне қарағанда әлдеқайда жоғары. Көміртектің электртерістілігі 2,5-ге тең, ауыр-14 элементтеріне қарағанда едәуір жоғары (1,8-1,9), бірақ жақын металдардың көпшілігіне, сондай-ақ екінші және үшінші қатарлардың кейбіріне жақын өтпелі металдар. Көміртегі коваленттік радиустар Әдетте 77.2 pm (C-C), 66.7 pm (C = C) және 60.3 pm (C≡C) деп қабылданады, бірақ олар координациялық санға және көміртектің байланысқанына байланысты өзгеруі мүмкін. Жалпы, ковалентті радиус координациялық санның төмендеуіне және байланыс ретін жоғарылатуға байланысты азаяды.[24]
Көміртекті қосылыстар бүкіл өмірдің негізін құрайды Жер, және көміртек-азот айналымы өндіретін энергияның бір бөлігін қамтамасыз етеді Күн және басқа да жұлдыздар. Ол қосылыстардың ерекше алуан түрлілігін құрағанымен, көміртегінің көп бөлігі қалыпты жағдайда салыстырмалы түрде реактивті емес. Стандартты температура мен қысым кезінде ол ең күшті тотықтырғыштардан басқаларына қарсы тұрады. Бұл реакция жасамайды күкірт қышқылы, тұз қышқылы, хлор немесе кез келген сілтілер. Жоғары температурада көміртек реакцияға түседі оттегі қалыптастыру көміртегі оксидтері және қарапайым металды қалдыру үшін металл оксидтерінен оттегін тонайды. Бұл экзотермиялық реакция дейін темір және болат өнеркәсібінде қолданылады балқыту темірдің құрамында және құрамында көміртек мөлшері бар болат:
- Fe
3O
4 + 4 C(-тер) → 3 Fe(-тер) + 4 CO(ж)
Көміртегі тотығын одан да көп балқыту үшін қайта өңдеуге болады:
- Fe
3O
4 + 4 CO(ж) → 3 Fe(-тер) + 4 CO
2(ж)
бірге күкірт қалыптастыру көміртекті дисульфид және көмір-газ реакциясы кезінде бумен:
- C(-тер) + H2O(ж) → CO(ж) + H2 (ж).
Көміртек кейбір металдармен жоғары температурада қосылып, темір карбиди сияқты металл карбидтерін түзеді цементит болатта және вольфрам карбиді ретінде кеңінен қолданылады абразивті және кесуге арналған құралдарға арналған кеңестер жасау үшін.
Көміртекті аллотроптар жүйесі бірқатар шектеулерді қамтиды:
| Графит - белгілі жұмсақ материалдардың бірі. | Синтетикалық нанокристалды гауһар белгілі ең қиын материал.[25] |
| Графит өте жақсы жағармай, көрсету суперклубия.[26] | Алмаз - бұл ең жоғарғы деңгей абразивті. |
| Графит - бұл дирижер электр қуаты.[27] | Алмаз - бұл керемет электр оқшаулағыш,[28] және белгілі материалдардың ішіндегі ең үлкен электр өрісі бар. |
| Графиттің кейбір формалары үшін қолданылады жылу оқшаулау (яғни өрт сөндіргіштер мен жылу қорғағыштар), бірақ кейбіреулері басқа нысандар жақсы жылу өткізгіштер болып табылады. | Алмаз - табиғи түрде кездесетін ең жақсы танымал жылу өткізгіш |
| Графит - мөлдір емес. | Алмаз өте мөлдір. |
| Графит кристалданады алты бұрышты жүйе.[29] | Гауһар кристалданады текше жүйе. |
| Аморфты көміртек толығымен изотропты. | Көміртекті нанотүтікшелер ең көп кездеседі анизотропты материалдар белгілі. |
Аллотроптар
Атомдық көміртек өте қысқа өмір сүретін түр, сондықтан көміртек әртүрлі молекулалық конфигурациялары бар әр түрлі атомды құрылымдарда тұрақтанады. аллотроптар. Көміртектің үш салыстырмалы түрде белгілі аллотроптары аморфты көміртегі, графит, және гауһар. Бір кездері экзотикалық болып саналды, фуллерендер қазіргі кезде синтезделіп, зерттеулерде қолданылады; олар кіреді баксболлар,[30][31] көміртекті нанотүтікшелер,[32] көміртекті нанобудтар[33] және наноталшықтар.[34][35] Сияқты тағы бірнеше экзотикалық аллотроптар табылды лондсалеит,[36] шыны тәрізді көміртек,[37] көміртекті нанобен[38] және сызықты ацетиленді көміртегі (карбейн).[39]
Графен - бұл алты өлшемді торда орналасқан атомдары бар көміртектің екі өлшемді парағы. 2009 жылдан бастап графен бұрын-соңды тексерілген ең берік материал болып көрінеді.[40] Оны бөлу процесі графит өндірістік процестер үшін үнемді болмай тұрып, одан әрі технологиялық дамуды қажет етеді.[41] Егер сәтті болса, графенді а құрылысында қолдануға болады ғарыш лифті. Ол сондай-ақ автомобильдерде сутегі негізіндегі қозғалтқышта пайдалану үшін сутекті қауіпсіз сақтау үшін қолданыла алады.[42]

The аморфты форма - бұл көміртек атомдарының кристалды макроқұрылымда ұсталмаған, біркелкі емес, әйнек тәрізді күйіндегі ассортименті. Ол ұнтақ ретінде қатысады және сияқты заттардың негізгі құрамдас бөлігі болып табылады көмір, шамдар (күйе ) және белсенді көмір. Қалыпты қысым кезінде көміртегі графит түрін алады, онда әрбір атом үш атомға тригональды түрде біріктірілген жазықтықта байланысады. алты бұрышты олар сияқты сақиналар хош иісті көмірсутектер.[43] Алынған желі екі өлшемді, ал алынған жалпақ парақтар қабаттасып, әлсіз арқылы байланған ван-дер-Ваальс күштері. Бұл графитке оның жұмсақтығын және оны береді кесу қасиеттері (парақтар бір-бірінен оңай өтіп кетеді). Әр атомның сыртқы электрондарының біреуін делокализациялауға байланысты а cloud-бұлт, графит өткізеді электр қуаты, бірақ әрқайсысының жазықтығында ғана ковалентті байланысқан парақ. Бұл төменгі көлемге әкеледі электр өткізгіштігі көпшілігіне қарағанда көміртегі үшін металдар. Бөлме температурасында алмаздың үстіндегі графиттің энергетикалық тұрақтылығы де делокализациядан тұрады.

Өте жоғары қысым кезінде көміртек неғұрлым ықшам аллотропты құрайды, гауһар графиттің тығыздығынан екі есеге жуық. Мұнда әр атом байланысады тетраэдрлік атомдардың алты мүшелі сақиналарының үш өлшемді торын құра отырып, тағы төртеуіне. Алмазда да бар кубтық құрылым сияқты кремний және германий және көміртегі-көміртектің беріктігі арқасында облигациялар, бұл табиғи түрде кездесетін ең қиын зат сызаттарға төзімділік. Деген кең таралған пікірге қайшы «алмастар мәңгі», олар термодинамикалық тұрақсыз (ΔfG° (алмас, 298 К) = 2,9 кДж / моль[44]) қалыпты жағдайда (298 К, 10)5 Па) және айналады графит.[18] Белсенді емес энергетикалық тосқауылдың арқасында графитке ауысу қалыпты температурада өте баяу жүреді, бұл оны байқамайды. Көміртектің фазалық диаграммасының төменгі сол жақ бұрышы эксперименталды түрде тексерілмеген. Алайда жақында жұмыс істейтін есептеуіш зерттеу тығыздықтың функционалдық теориясы әдістері деген қорытындыға келді Т → 0 K және б → 0 Паалмас болады неғұрлым тұрақты графитке қарағанда шамамен 1,1 кДж / моль.[45] Кейбір жағдайларда көміртек кристаллданады лондсалеит, а алты бұрышты кристалл барлық атомдары ковалентті байланысқан және қасиеттері алмасқа ұқсас тор.[36]
Фуллерендер құрылымы графит тәрізді, бірақ жазық орнына синтетикалық кристалды түзіліс алты бұрышты жасушалар тек кейбір клеткалары фуллерендер түзілетін бесбұрыштар, жазықсыз алтыбұрыштар, тіпті көміртек атомдарының гептагондары болуы мүмкін. Осылайша, парақтар сфераларға, эллиптерге немесе цилиндрлерге айналады. Фуллерендердің қасиеттері (бакли, шарик, нанобудтарға бөлінеді) әлі толық талданбаған және зерттеудің қарқынды бағытын білдіреді наноматериалдар. Атаулар фуллерен және боксбол кейін беріледі Ричард Бакминстер Фуллер, танымал геодезиялық күмбездер, олар фуллерендердің құрылымына ұқсайды. Баккиболлар - бұл тригональды байланысқан көміртектен толығымен қалыптасқан, түзілетін едәуір үлкен молекулалар сфероидтар (ең танымал және қарапайым - футбол формасындағы С60 buckminsterfullerene ).[30] Көміртекті нанотүтікшелер (бактитюбтер) құрылымы жағынан баксиболларға ұқсас, тек әрбір атом қуыс түзетін қисық парақта тригональды байланысады. цилиндр.[31][32] Нанобудтер алғаш рет 2007 жылы тіркелген және екеуінің де қасиеттерін бір құрылымға біріктіретін гибридті бактитуб / баккибол материалдары (баксиболлар нанотүтікшенің сыртқы қабырғасына ковалентті байланысады).[33]

Басқа табылған аллотроптардан көміртекті нанобен Бұл ферромагниттік 1997 жылы ашылған аллотроп. Ол атомдар алты және жеті мүшелі сақиналарда тригональды байланысқан үш өлшемді торда бір-бірімен тығыз орналасқан көміртек атомдарының тығыздығы төмен кластерлік жиынтығынан тұрады. Ол тығыздығы шамамен 2 кг / м болатын ең жеңіл қатты денелердің қатарына жатады3.[46] Сол сияқты, шыны тәрізді көміртек жабық үлесінің жоғары үлесін қамтиды кеуектілік,[37] бірақ қалыпты графитке қарама-қарсы графиттік қабаттар кітаптағы парақтар сияқты жинақталмайды, бірақ кездейсоқ орналасады. Сызықтық ацетиленді көміртегі[39] химиялық құрылымы бар[39] - (C ::: C)n-. Бұл модификациядағы көміртек сызықты sp орбиталық будандастыру, және а полимер айнымалы жалғыз және үштік байланыстармен. Бұл карбинн айтарлықтай қызығушылық тудырады нанотехнология оның Янг модулі бұл ең қиын материал - алмаздан 40 есе артық.[47]
2015 жылы команда Солтүстік Каролина штатының университеті деп атаған тағы бір аллотроптың дамуын жариялады Q-көміртегі, аморфты көміртекті шаңға жоғары энергиялық төмен лазерлік импульспен жасалады. Q-көміртегі ферромагнетизмді көрсетеді, флуоресценция және қаттылығы гауһардан жоғары.[48]
Бу фазасында көміртектің бір бөлігі формада болады дикарбон (C
2). Қуанған кезде бұл газ жасыл болып жанады.
Пайда болу


Көміртегі - төртінші химиялық элемент ішінде бақыланатын ғалам сутегі, гелий және оттектен кейінгі массасы бойынша. 2020 жылдың шілдесінде астрономдар көміртектің негізінен пайда болғандығы туралы дәлелдер келтірді ақ ергежейлі жұлдыздар, әсіресе екі күн массасынан үлкендер.[49][50] Көміртегі құрамында көп Күн, жұлдыздар, кометалар, және атмосфера көпшілігінде планеталар.[51] Кейбіреулер метеориттер кезінде пайда болған микроскопиялық алмастар бар күн жүйесі әлі де болды планеталық диск.[52] Микроскопиялық гауһар метеориттің әсер ететін жерлеріндегі қатты қысым мен жоғары температурадан да пайда болуы мүмкін.[53]
2014 жылы НАСА жариялады мәліметтер базасы айтарлықтай жаңартылды бақылау үшін полициклді ароматты көмірсутектер Ішіндегі (PAHs) ғалам. Ғаламдағы көміртектің 20% -дан астамы оттегісіз көміртегі мен сутектің күрделі қосылыстары PAH-мен байланысты болуы мүмкін.[54] Бұл қосылыстар PAH әлемдік гипотезасы онда олар рөл атқарады деп болжанған абиогенез және қалыптасуы өмір. PAH-лар «екі миллиард жылдан кейін» қалыптасқан сияқты Үлкен жарылыс, бүкіл әлемде кең таралған және олармен байланысты жаңа жұлдыздар және экзопланеталар.[51]
Тұтас жердің құрамында 730 болады деп есептелген бет / мин көміртегі, ядросында 2000 мин / мин, ал аралас мантия мен жер қыртысында 120 айн / мин.[55] Жердің массасы болғандықтан 5.972×1024 кг, бұл 4360 млн гигатонес көміртегі Бұл мұхиттардағы немесе атмосферадағы көміртектің мөлшерінен әлдеқайда көп (төменде).
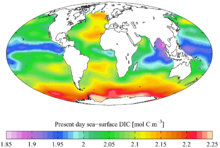
Бірге оттегі жылы Көмір қышқыл газы, көміртегі Жер атмосферасында кездеседі (шамамен 900 гигатонна көміртегі - әрбір промилл / мин 2.3 Гт сәйкес келеді) және барлық су объектілерінде еріген (шамамен 36000 гигатонна көміртек). Көміртегі биосфера 550 гигатоннаға бағаланған, бірақ үлкен сенімсіздікпен, негізінен жердегі тереңдіктің үлкен белгісіздігіне байланысты жер асты бактериялары.[56] Көмірсутектер (сияқты көмір, мұнай, және табиғи газ ) құрамында көміртек бар. Көмір «қорлар» («ресурстар» емес) шамамен 900 гигатоннаны құрайды, мүмкін 18000 Гт ресурстармен.[57] Мұнай қоры шамамен 150 гигатоннды құрайды. Табиғи газдың дәлелденген көздері туралы 175×1012 текше метр (құрамында 105 гигатонна көміртегі бар), бірақ зерттеулер басқасын бағалайды 900×1012 текше метр сияқты «дәстүрлі емес» кен орындарының тақтатас газы, шамамен 540 гигатонна көміртекті құрайды.[58]
Көміртек құрамында да кездеседі метан гидраттары полярлық аймақтарда және теңіз астында. Әр түрлі болжамдар бойынша бұл көміртекті 500, 2500 аралығында деп санайды Гт,[59] немесе 3000 Гт.[60]
Бұрын көмірсутектердің мөлшері көп болатын. Бір дерек бойынша 1751-2008 жылдар аралығында көміртегі диоксиді ретінде шамамен 347 гигатонна көміртегі атмосфераға жанармайдың жануынан атмосфераға шығарылды.[61] Тағы бір дерек көзі 1750 жылдан бастап атмосфераға 879 Гт-ге тең мөлшерді қосады және жалпы атмосфераға, теңізге және құрлыққа кетеді (мысалы шымтезек батпақтар ) шамамен 2000 Гт.[62]
Көміртек - бұл өте үлкен массалардың құрамдас бөлігі (массасы бойынша шамамен 12%) карбонат тау жынысы (әктас, доломит, мәрмәр және тағы басқа). Көмір көміртегіге өте бай (антрацит құрамында 92–98%)[63] және 4000 гигатоннаны немесе 80% -ды құрайтын минералды көміртектің ірі коммерциялық көзі болып табылады қазба отын.[64]
Жеке көміртекті аллотроптарға келетін болсақ, графит АҚШ (негізінен Нью Йорк және Техас ), Ресей, Мексика, Гренландия, және Үндістан. Табиғи гауһар тастарда кездеседі кимберлит, ежелгі уақытта табылған жанартау «мойындар» немесе «құбырлар». Алмаз кен орындарының көпшілігі Африка, атап айтқанда Оңтүстік Африка, Намибия, Ботсвана, Конго Республикасы, және Сьерра-Леоне. Гауһар кен орындары да табылған Арканзас, Канада, орыс Арктика, Бразилия, ал солтүстік және батыста Австралия. Қазір гауһар тастар мұхит түбінен шығарылып жатыр Жақсы үміт мүйісі. Гауһар тастар табиғи түрде кездеседі, бірақ қазіргі кезде АҚШ-та қолданылатын барлық гауһар тастардың шамамен 30% өндіріледі.
Көміртек-14 тропосфераның жоғарғы қабаттарында және стратосферада 9–15 км биіктікте реакция нәтижесінде түзіледі. ғарыштық сәулелер.[65] Термиялық нейтрондар азот-14 ядроларымен соқтығысып, көміртек-14 және протон түзетін шығарылады. Тап мұндай, 1.5%×10−10 атмосфералық көмірқышқыл газының құрамында көміртек-14 болады.[66]
Көміртегі мол астероидтар сыртқы бөліктерінде салыстырмалы түрде басым астероид белдеуі Біздің күн жүйесі. Бұл астероидтардан ғалымдар әлі тікелей сынама алған жоқ. Астероидтарды гипотетикалық түрде қолдануға болады кеңістіктегі көміртекті өндіру, бұл болашақта мүмкін болуы мүмкін, бірақ қазіргі кезде технологиялық жағынан мүмкін емес.[67]
Изотоптар
Изотоптар көміртегі бар атом ядролары құрамында алты протондар плюс саны нейтрондар (2-ден 16-ға дейін). Көміртектің екі тұрақты, табиғи күйінде болады изотоптар.[15] Изотоп көміртек-12 (12C) жердегі көміртектің 98,93% құрайды, ал көміртек-13 (13C) қалған 1,07% құрайды.[15] Концентрациясы 12С биологиялық материалдарда одан әрі жоғарылайды, себебі биохимиялық реакциялар дискриминациялайды 13C.[68] 1961 жылы Халықаралық таза және қолданбалы химия одағы (IUPAC) изотопты қабылдады көміртек-12 үшін негіз ретінде атомдық салмақ.[69] Көміртекті идентификациялау ядролық магниттік резонанс (NMR) эксперименттер изотоппен жасалады 13C.
Көміртек-14 (14C) табиғи түрде кездеседі радиоизотоп, жылы жасалған атмосфераның жоғарғы қабаты (төменгі стратосфера және жоғарғы тропосфера ) өзара әрекеттесу арқылы азот бірге ғарыштық сәулелер.[70] Ол жер бетінде 1 бөліктен аз мөлшерде кездеседі триллион (0,0000000001%) немесе одан көп, көбінесе атмосферада және үстіңгі қабаттарда, әсіресе шымтезек және басқа органикалық материалдар.[71] Бұл изотоп 0,158 МэВ-қа ыдырайды β− эмиссия. Оның салыстырмалы түрде қысқа болғандықтан Жартылай ыдырау мерзімі 5730 жыл, 14С ежелгі жыныстарда іс жүзінде жоқ. Мөлшері 14С атмосфера және тірі организмдерде үнемі дерлік болады, бірақ өлгеннен кейін олардың денесінде болжау бойынша азаяды. Бұл принцип қолданылады радиокөміртекті кездесу, 1949 жылы ойлап тапты, ол көміртекті материалдардың жасын шамамен 40 000 жылға дейін анықтау үшін кеңінен қолданылады.[72][73]
Көміртектің белгілі 15 изотопы бар, ал ең қысқа өмір сүреді 8Ол ыдырайды протон эмиссиясы және альфа ыдырауы және жартылай шығарылу кезеңі 1,98739 × 10−21 с.[74] Экзотикалық 19C экспонаттары а ядролық гало бұл оның мағынасын білдіреді радиусы күтілетіннен едәуір үлкен ядро болды сфера тұрақты тығыздық.[75]
Жұлдыздарда пайда болу
Көміртекті атом ядросының қалыптасуы а шегінде жүреді алып немесе керемет арқылы жұлдыз үштік альфа-процесс. Бұл үш бірдей соқтығысуды қажет етеді альфа бөлшектері (гелий әрі қарайғы өнім ретінде) ядролық синтез гелийдің сутегімен немесе басқа гелий ядросымен реакциясы пайда болады литий-5 және берилий-8 сәйкесінше, екеуі де өте тұрақсыз және дереу қайтадан кішігірім ядроларға айналады.[76] Үштік альфа процесі 100 мегакелвиннен жоғары температура жағдайында жүреді және ерте ғаламның тез кеңеюіне және салқындауына тыйым салған гелий концентрациясы жағдайында жүреді, демек, көміртегі Үлкен жарылыс.
Қазіргі физикалық космология теориясы бойынша көміртегі жұлдыздардың интерьерінде түзіледі көлденең тармақ.[77] Үлкен жұлдыздар супернова ретінде өлгенде, көміртек шаң ретінде кеңістікке шашырайды. Бұл шаң түзілудің құрамдас материалы болады жаңа буын жұлдызы планеталары бар жүйелер.[51][78] The Күн жүйесі бұл біз білетін тіршіліктің пайда болуына мүмкіндік беретін көміртегі көп жұлдыздардың бірі.
The CNO циклі бұл жұлдыздарды қуаттандыратын қосымша сутегі синтезінің механизмі, мұнда көміртек а ретінде жұмыс істейді катализатор.
Көміртек оксидінің әртүрлі изотоптық формаларының айналмалы ауысулары (мысалы, 12CO, 13CO, және 18CO) анықталады субмиллиметр толқын ұзындығының диапазоны, және зерттеу кезінде қолданылады жаңадан пайда болған жұлдыздар жылы молекулалық бұлттар.[79]
Көміртегі айналымы
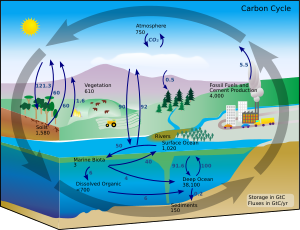
Құрлық жағдайында бір элементтің екіншісіне ауысуы өте сирек кездеседі. Демек, жердегі көміртектің мөлшері тұрақты түрде тұрақты болады. Осылайша, көміртекті қолданатын процестер оны бір жерден алып, басқа жерге тастауы керек. Қоршаған ортадағы көміртектің жүру жолдары көміртегі айналымы. Мысалға, фотосинтетикалық өсімдіктер сурет салады Көмір қышқыл газы атмосферадан (немесе теңіз суынан) және оны биомассаға айналдырады Кальвин циклі, процесі көміртекті бекіту. Осы биомассаның бір бөлігін жануарлар жейді, ал кейбір көміртекті жануарлар көмірқышқыл газы ретінде шығарады. Көміртегінің циклы осы қысқа контурға қарағанда едәуір күрделі; мысалы, кейбір көмірқышқыл газы мұхиттарда ериді; егер бактериялар оны қолданбаса, өлі өсімдік немесе жануарлар заты пайда болуы мүмкін мұнай немесе көмір, ол жанған кезде көміртекті шығарады.[80][81]
Қосылыстар
Органикалық қосылыстар


Көміртек өте ұзақ өзара байланыс тізбектерін құра алады көміртек-көміртекті байланыстар, деп аталатын қасиет катенация. Көміртек-көміртегі байланыстары берік және тұрақты. Катенация арқылы көміртек сансыз қосылыстар түзеді. Бірегей қосылыстардың саны көміртектің құрамында жоқтығынан көп екенін көрсетеді.[82] Ұқсас сутекті сутегіге де қоюға болады, өйткені органикалық қосылыстардың көпшілігінде көміртегімен химиялық байланысқан сутегі немесе оттегі немесе азот сияқты басқа қарапайым элемент бар.
Органикалық молекуланың қарапайым түрі - бұл көмірсутегі - үлкен отбасы органикалық молекулалар құрамына кіреді сутегі көміртек атомдар тізбегімен байланысқан атомдар Көмірсутегі магистралін басқа атомдар алмастыра алады, олар белгілі гетероатомдар. Органикалық қосылыстарда кездесетін кәдімгі гетероатомдарға оттегі, азот, күкірт, фосфор және радиоактивті емес галогендер, литий мен магний металдары жатады. Металлмен байланысы бар органикалық қосылыстар органометалл қосылыстары ретінде белгілі (төменде қараңыз). Атомдардың белгілі бір топтастырылуы, көбінесе гетероатомдарды қоса алғанда, көптеген органикалық қосылыстарда қайталанады. Бұл коллекциялар, ретінде белгілі функционалдық топтар, жалпы реактивтіліктің заңдылықтарын ұсынады және органикалық қосылыстарды жүйелі түрде зерттеуге және санаттауға мүмкіндік береді. Тізбектің ұзындығы, формасы және функционалды топтары барлығы органикалық молекулалардың қасиеттеріне әсер етеді.
Көміртектің тұрақты қосылыстарының көпшілігінде (және барлығы дерлік тұрақты) органикалық қосылыстар), көміртек сегіздік ереже және болып табылады төрт валентті, яғни көміртек атомы төрт ковалентті байланыстарды құрайды (олар екі және үштік байланыстарды қамтуы мүмкін). Ерекше жағдайларға тұрақтандырылғандардың аз саны жатады көмірсулар (үш облигация, оң заряд), радикалдар (үш байланыс, бейтарап), карбаниондар (үш байланыс, теріс заряд) және карбендер (екі байланыс, бейтарап), дегенмен бұл түрлер тұрақсыз, реактивті аралық ретінде кездеседі.
Көміртегі бәріне белгілі органикалық өмірі және негізі болып табылады органикалық химия. Біріктірілген кезде сутегі, ол өнеркәсіп үшін маңызды әр түрлі көмірсутектерді құрайды салқындатқыштар, жағар майлар, еріткіштер, өндірісі үшін химиялық шикізат ретінде пластмасса және мұнай-химия, және қазба отындары.
Көміртегі оттегімен және сутегімен үйлескенде көптеген маңызды биологиялық қосылыстар тобын құра алады, соның ішінде қанттар, лигнандар, хитиндер, алкоголь, майлар және хош иісті күрделі эфирлер, каротиноидтар және терпендер. Бірге азот ол қалыптасады алкалоидтар, және күкірт қосқанда да түзіледі антибиотиктер, аминқышқылдары, және резеңке өнімдер. Осы басқа элементтерге фосфор қосылған кезде ол түзіледі ДНҚ және РНҚ, тіршіліктің химиялық-кодтық тасымалдаушылары және аденозинтрифосфат (ATP), барлық тірі жасушалардағы ең маңызды энергия тасымалдайтын молекула.
Бейорганикалық қосылыстар
Минералдармен байланысқан немесе құрамында басқа көміртек атомдарымен, галогендермен немесе сутегімен байланыссыз көміртегі бар қосылыстар классикалықтан бөлек қарастырылады органикалық қосылыстар; анықтама қатаң емес, ал кейбір қосылыстардың жіктелуі әр автордан әр түрлі болуы мүмкін (жоғарыдағы сілтеме мақалаларын қараңыз). Олардың ішінде қарапайым көміртегі оксидтері бар. Ең көрнекті оксид Көмір қышқыл газы (CO
2). Бұл бір кездері негізгі құрылтайшы болды палеоатмосфера, бірақ-тың кіші компоненті болып табылады Жер атмосферасы бүгін.[83] Ерітілген су, ол қалыптасады көмір қышқылы (H
2CO
3), бірақ бір көміртегіге көп байланысқан оксигендермен қосылыстардың көпшілігі тұрақсыз.[84] Осы аралық арқылы резонанс тұрақтандырылды карбонат иондар өндіріледі. Кейбір маңызды минералдар карбонаттар болып табылады, атап айтқанда кальцит. Көміртекті дисульфид (CS
2) ұқсас.[23] Соған қарамастан, физикалық қасиеттері мен органикалық синтезмен байланысы арқасында кейде көміртегі дисульфидін ан органикалық еріткіш.
Басқа қарапайым оксид көміртегі тотығы (CO). Ол толық емес жанудан пайда болады және түссіз, иіссіз газ болып табылады. Молекулалардың әрқайсысында үштік байланыс бар және олар өте әділ полярлы нәтижесінде гемоглобин молекулаларымен тұрақты байланыс тенденциясы пайда болады, оттегіні ығыстырып шығарады, байланыстырушы жақындығы төмен.[85][86] Цианид (CN−), ұқсас құрылымы бар, бірақ а сияқты әрекет етеді галоид ион (жалған галоген ). Мысалы, ол нитрид түзе алады цианоген молекула ((CN)2), диатомдық галогенидтерге ұқсас. Сол сияқты, ауыр цианид аналогы, цифид (CP−), сонымен қатар бейорганикалық болып саналады, дегенмен көптеген қарапайым туындылар өте тұрақсыз. Басқа сирек кездесетін оксидтер болып табылады көміртегі тотығы (C
3O
2),[87] тұрақсыз дикарбон тотығы (C2O),[88][89] көмірқышқыл газы (CO3),[90][91] циклопентанепентон (C5O5),[92] циклогексангексон (C6O6),[92] және меллис ангидриді (C12O9). Алайда, мелли ангидриді - бұл мелли қышқылының үштік ацил ангидриді; сонымен қатар оның құрамында бензол сақинасы бар. Осылайша, көптеген химиктер оны органикалық деп санайды.
Реактивті металдар, сияқты вольфрам, көміртегі карбидтер (C4−) немесе ацетилидтер (C2−
2) балқу температурасы жоғары қорытпалар қалыптастыру. Бұл аниондар да байланысты метан және ацетилен, екеуі де өте әлсіз қышқылдар. Электр терістігі 2,5,[93] көміртегі түзілуді қалайды ковалентті байланыстар. Бірнеше карбидтер ковалентті торлар болып табылады карборунд Ұқсас (SiC) гауһар. Дегенмен, карбидтердің ең полярлы және тұз тәрізділері де толық иондық қосылыстар емес.[94]
Органометалл қосылыстары
Органометалл қосылыстары анықтамасы бойынша кем дегенде бір көміртекті-металл ковалентті байланысқа ие. Мұндай қосылыстардың кең ауқымы бар; негізгі кластарға қарапайым алкил-металды қосылыстар жатады (мысалы, тетраэтиллеад ), η2-алкен қосылыстары (мысалы, Зейзенің тұзы ) және η3-аллил қосылыстары (мысалы, аллпалладий хлоридінің димері ); металлоцендер құрамында циклопентадиенил лигандары бар (мысалы, ферроцен ); және өтпелі металл карбенді кешендер. Көптеген металл карбонилдері және металл цианидтері бар (мысалы, тетракарбонилникель және калий феррицианы ); кейбір жұмысшылар басқа көміртек лигандары жоқ металл карбонил және цианидті кешендерді органикалық емес, тек бейорганикалық деп санайды. Алайда, көптеген металлорганикалық химиктер кез-келген көміртекті лигандпен, тіпті «бейорганикалық көміртекпен» (мысалы, карбонилдер, цианидтермен, карбидтер мен ацетилидтермен) метал кешендерін табиғатта органометалл деп санайды. Құрамында көміртегі-металл ковалентті байланысы жоқ органикалық лигандтар бар металл кешендері (мысалы, металл карбоксилаттары) металлорганикалық қосылыстар.
While carbon is understood to strongly prefer formation of four covalent bonds, other exotic bonding schemes are also known. Carboranes are highly stable dodecahedral derivatives of the [B12H12]2- unit, with one BH replaced with a CH+. Thus, the carbon is bonded to five boron atoms and one hydrogen atom. The cation [(Ph3PAu)6C]2+ contains an octahedral carbon bound to six phosphine-gold fragments. This phenomenon has been attributed to the aurophilicity of the gold ligands, which provide additional stabilization of an otherwise labile species.[95] In nature, the iron-molybdenum cofactor (FeMoco ) responsible for microbial nitrogen fixation likewise has an octahedral carbon center (formally a carbide, C(-IV)) bonded to six iron atoms. In 2016, it was confirmed that, in line with earlier theoretical predictions, the hexamethylbenzene dication contains a carbon atom with six bonds. More specifically, the dication could be described structurally by the formulation [MeC(η5-C5Me5)]2+, making it an "organic metallocene " in which a MeC3+ fragment is bonded to a η5-C5Me5− fragment through all five of the carbons of the ring.[96]
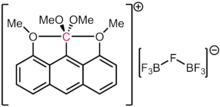
It is important to note that in the cases above, each of the bonds to carbon contain less than two formal electron pairs. Thus, the formal electron count of these species does not exceed an octet. This makes them hypercoordinate but not hypervalent. Even in cases of alleged 10-C-5 species (that is, a carbon with five ligands and a formal electron count of ten), as reported by Akiba and co-workers,[97] electronic structure calculations conclude that the electron population around carbon is still less than eight, as is true for other compounds featuring four-electron three-center bonding.
History and etymology

The Ағылшын name carbon comes from the Латын carbo for coal and charcoal,[98] whence also comes the French charbon, meaning charcoal. Жылы German, Dutch және Дат, the names for carbon are Kohlenstoff, koolstof және kulstof respectively, all literally meaning coal -substance.
Carbon was discovered in prehistory and was known in the forms of soot және charcoal to the earliest human өркениеттер. Diamonds were known probably as early as 2500 BCE in China, while carbon in the form of charcoal was made around Roman times by the same chemistry as it is today, by heating wood in a pyramid covered with clay to exclude air.[99][100]
In 1722, René Antoine Ferchault de Réaumur demonstrated that iron was transformed into steel through the absorption of some substance, now known to be carbon.[101] In 1772, Antoine Lavoisier showed that diamonds are a form of carbon; when he burned samples of charcoal and diamond and found that neither produced any water and that both released the same amount of carbon dioxide per gram.In 1779,[102] Carl Wilhelm Scheele showed that graphite, which had been thought of as a form of lead, was instead identical with charcoal but with a small admixture of iron, and that it gave "aerial acid" (his name for carbon dioxide) when oxidized with nitric acid.[103] In 1786, the French scientists Claude Louis Berthollet, Gaspard Monge and C. A. Vandermonde confirmed that graphite was mostly carbon by oxidizing it in oxygen in much the same way Lavoisier had done with diamond.[104] Some iron again was left, which the French scientists thought was necessary to the graphite structure. In their publication they proposed the name carbone (Latin carbonum) for the element in graphite which was given off as a gas upon burning graphite. Antoine Lavoisier then listed carbon as an element in his 1789 textbook.[105]
A new allotrope of carbon, fullerene, that was discovered in 1985[106] includes nanostructured forms such as buckyballs және nanotubes.[30] Their discoverers – Robert Curl, Harold Kroto және Richard Smalley – received the Нобель сыйлығы in Chemistry in 1996.[107] The resulting renewed interest in new forms lead to the discovery of further exotic allotropes, including glassy carbon, and the realization that "amorphous carbon " is not strictly amorphous.[37]
Production
Graphite
Commercially viable natural deposits of graphite occur in many parts of the world, but the most important sources economically are in Қытай, Үндістан, Бразилия және Солтүстік Корея. Graphite deposits are of metamorphic origin, found in association with quartz, mica және feldspars in schists, gneisses and metamorphosed sandstones және limestone as lenses немесе veins, sometimes of a metre or more in thickness. Deposits of graphite in Borrowdale, Камберланд, Англия were at first of sufficient size and purity that, until the 19th century, pencils were made simply by sawing blocks of natural graphite into strips before encasing the strips in wood. Today, smaller deposits of graphite are obtained by crushing the parent rock and floating the lighter graphite out on water.[108]
There are three types of natural graphite—amorphous, flake or crystalline flake, and vein or lump. Amorphous graphite is the lowest quality and most abundant. Contrary to science, in industry "amorphous" refers to very small crystal size rather than complete lack of crystal structure. Amorphous is used for lower value graphite products and is the lowest priced graphite. Large amorphous graphite deposits are found in China, Europe, Mexico and the United States. Flake graphite is less common and of higher quality than amorphous; it occurs as separate plates that crystallized in metamorphic rock. Flake graphite can be four times the price of amorphous. Good quality flakes can be processed into expandable graphite for many uses, such as flame retardants. The foremost deposits are found in Austria, Brazil, Canada, China, Germany and Madagascar. Vein or lump graphite is the rarest, most valuable, and highest quality type of natural graphite. It occurs in veins along intrusive contacts in solid lumps, and it is only commercially mined in Sri Lanka.[108]
Сәйкес USGS, world production of natural graphite was 1.1 million tonnes in 2010, to which China contributed 800,000 t, India 130,000 t, Brazil 76,000 t, North Korea 30,000 t and Canada 25,000 t. No natural graphite was reported mined in the United States, but 118,000 t of synthetic graphite with an estimated value of $998 million was produced in 2009.[108]
Diamond

The diamond supply chain is controlled by a limited number of powerful businesses, and is also highly concentrated in a small number of locations around the world (see figure).
Only a very small fraction of the diamond ore consists of actual diamonds. The ore is crushed, during which care has to be taken in order to prevent larger diamonds from being destroyed in this process and subsequently the particles are sorted by density. Today, diamonds are located in the diamond-rich density fraction with the help of X-ray fluorescence, after which the final sorting steps are done by hand. Before the use of X-rays became commonplace, the separation was done with grease belts; diamonds have a stronger tendency to stick to grease than the other minerals in the ore.[109]
Historically diamonds were known to be found only in alluvial deposits in southern India.[110] India led the world in diamond production from the time of their discovery in approximately the 9th century BC[111] to the mid-18th century AD, but the commercial potential of these sources had been exhausted by the late 18th century and at that time India was eclipsed by Brazil where the first non-Indian diamonds were found in 1725.[112]
Diamond production of primary deposits (kimberlites and lamproites) only started in the 1870s after the discovery of the diamond fields in South Africa. Production has increased over time and now an accumulated total of 4.5 billion carats have been mined since that date.[113] About 20% of that amount has been mined in the last 5 years alone, and during the last ten years 9 new mines have started production while 4 more are waiting to be opened soon. Most of these mines are located in Canada, Zimbabwe, Angola, and one in Russia.[113]
In the United States, diamonds have been found in Arkansas, Colorado және Montana.[114][115] In 2004, a startling discovery of a microscopic diamond in the United States[116] led to the January 2008 bulk-sampling of kimberlite pipes in a remote part of Montana.[117]
Today, most commercially viable diamond deposits are in Ресей, Botswana, Австралия және Democratic Republic of Congo.[118] In 2005, Russia produced almost one-fifth of the global diamond output, reports the British Geological Survey. Australia has the richest diamantiferous pipe with production reaching peak levels of 42 metric tons (41 long tons; 46 short tons) per year in the 1990s.[114] There are also commercial deposits being actively mined in the Northwest Territories туралы Канада, Siberia (mostly in Yakutia territory; for example, Mir pipe және Udachnaya pipe ), Brazil, and in Northern and Western Австралия.
Қолданбалар




Carbon is essential to all known living systems, and without it life as we know it could not exist (see alternative biochemistry ). The major economic use of carbon other than food and wood is in the form of hydrocarbons, most notably the fossil fuel methane gas and crude oil (petroleum). Crude oil болып табылады distilled жылы refineries бойынша petrochemical industry to produce gasoline, kerosene, and other products. Cellulose is a natural, carbon-containing polymer produced by plants in the form of wood, cotton, linen, және hemp. Cellulose is used primarily for maintaining structure in plants. Commercially valuable carbon polymers of animal origin include wool, cashmere және silk. Plastics are made from synthetic carbon polymers, often with oxygen and nitrogen atoms included at regular intervals in the main polymer chain. The raw materials for many of these synthetic substances come from crude oil.
The uses of carbon and its compounds are extremely varied. It can form alloys бірге iron, of which the most common is carbon steel. Graphite is combined with clays to form the 'lead' used in pencils үшін қолданылған writing және drawing. It is also used as a lubricant және а pigment, as a molding material in glass manufacture, in electrodes for dry batteries және electroplating және electroforming, жылы brushes үшін electric motors and as a neutron moderator жылы nuclear reactors.
Charcoal is used as a drawing material in artwork, barbecue grilling, iron smelting, and in many other applications. Wood, coal and oil are used as жанармай for production of energy and heating. Gem quality diamond is used in jewelry, and industrial diamonds are used in drilling, cutting and polishing tools for machining metals and stone. Plastics are made from fossil hydrocarbons, and carbon fiber, made by pyrolysis of synthetic polyester fibers is used to reinforce plastics to form advanced, lightweight composite materials.
Carbon fiber is made by pyrolysis of extruded and stretched filaments of polyacrylonitrile (PAN) and other organic substances. The crystallographic structure and mechanical properties of the fiber depend on the type of starting material, and on the subsequent processing. Carbon fibers made from PAN have structure resembling narrow filaments of graphite, but thermal processing may re-order the structure into a continuous rolled sheet. The result is fibers with higher specific tensile strength than steel.[119]
Carbon black is used as the black pigment жылы printing ink, artist's oil paint and water colours, carbon paper, automotive finishes, India ink және laser printer toner. Carbon black is also used as a filler жылы rubber products such as tyres and in plastic compounds. Activated charcoal is used as an absorbent және adsorbent жылы filter material in applications as diverse as gas masks, water purification, және kitchen extractor hoods, and in medicine to absorb toxins, poisons, or gases from the digestive system. Carbon is used in chemical reduction at high temperatures. Coke is used to reduce iron ore into iron (smelting). Case hardening of steel is achieved by heating finished steel components in carbon powder. Carbides туралы silicon, tungsten, boron және titanium, are among the hardest known materials, and are used as abrasives in cutting and grinding tools. Carbon compounds make up most of the materials used in clothing, such as natural and synthetic textiles және leather, and almost all of the interior surfaces in the built environment other than glass, stone and metal.
Diamonds
The diamond industry falls into two categories: one dealing with gem-grade diamonds and the other, with industrial-grade diamonds. While a large trade in both types of diamonds exists, the two markets function dramatically differently.
Айырмашылығы жоқ precious metals сияқты gold немесе platinum, gem diamonds do not trade as a commodity: there is a substantial mark-up in the sale of diamonds, and there is not a very active market for resale of diamonds.
Industrial diamonds are valued mostly for their hardness and heat conductivity, with the gemological qualities of clarity and color being mostly irrelevant. About 80% of mined diamonds (equal to about 100 million carats or 20 tonnes annually) are unsuitable for use as gemstones are relegated for industrial use (known as bort ).[120] synthetic diamonds, invented in the 1950s, found almost immediate industrial applications; 3 billion carats (600 tonnes ) of synthetic diamond is produced annually.[121]
The dominant industrial use of diamond is in cutting, drilling, grinding, and polishing. Most of these applications do not require large diamonds; in fact, most diamonds of gem-quality except for their small size can be used industrially. Diamonds are embedded in drill tips or saw blades, or ground into a powder for use in grinding and polishing applications.[122] Specialized applications include use in laboratories as containment for high pressure experiments (қараңыз diamond anvil cell ), high-performance bearings, and limited use in specialized windows.[123][124] With the continuing advances in the production of synthetic diamonds, new applications are becoming feasible. Garnering much excitement is the possible use of diamond as a semiconductor suitable for microchips, and because of its exceptional heat conductance property, as a heat sink жылы electronics.[125]
Precautions

Pure carbon has extremely low toxicity to humans and can be handled safely in the form of graphite or charcoal. It is resistant to dissolution or chemical attack, even in the acidic contents of the digestive tract. Consequently, once it enters into the body's tissues it is likely to remain there indefinitely. Carbon black was probably one of the first pigments to be used for tattooing, және Ötzi the Iceman was found to have carbon tattoos that survived during his life and for 5200 years after his death.[126] Inhalation of coal dust or soot (carbon black) in large quantities can be dangerous, irritating lung tissues and causing the congestive lung disease, coalworker's pneumoconiosis. Diamond dust used as an abrasive can be harmful if ingested or inhaled. Microparticles of carbon are produced in diesel engine exhaust fumes, and may accumulate in the lungs.[127] In these examples, the harm may result from contaminants (e.g., organic chemicals, heavy metals) rather than from the carbon itself.
Carbon generally has low toxicity to life on Earth; but carbon nanoparticles are deadly to Drosophila.[128]
Carbon may burn vigorously and brightly in the presence of air at high temperatures. Large accumulations of coal, which have remained inert for hundreds of millions of years in the absence of oxygen, may spontaneously combust when exposed to air in coal mine waste tips, ship cargo holds and coal bunkers,[129][130] and storage dumps.
Жылы nuclear applications where graphite is used as a neutron moderator, accumulation of Wigner energy followed by a sudden, spontaneous release may occur. Annealing to at least 250 °C can release the energy safely, although in the Windscale fire the procedure went wrong, causing other reactor materials to combust.
The great variety of carbon compounds include such lethal poisons as tetrodotoxin, lectin ricin from seeds of the castor oil plant Ricinus communis, cyanide (CN−), and carbon monoxide; and such essentials to life as glucose және protein.
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ а б Haaland, D (1976). "Graphite-liquid-vapor triple point pressure and the density of liquid carbon". Carbon. 14 (6): 357–361. дои:10.1016/0008-6223(76)90010-5.
- ^ а б Savvatimskiy, A (2005). "Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)". Carbon. 43 (6): 1115–1142. дои:10.1016/j.carbon.2004.12.027.
- ^ "Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical" (PDF). Алынған 2007-12-06.
- ^ "Fourier Transform Spectroscopy of the System of CP" (PDF). Алынған 2007-12-06.
- ^ "Carbon: Binary compounds". Алынған 2007-12-06.
- ^ а б c г. e Properties of diamond, Ioffe Institute Database
- ^ "Material Properties- Misc Materials". www.nde-ed.org. Алынған 12 November 2016.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 978-0-8493-0464-4.
- ^ "History of Carbon and Carbon Materials - Center for Applied Energy Research - University of Kentucky". Caer.uky.edu. Алынған 2008-09-12.
- ^ Senese, Fred (2000-09-09). "Who discovered carbon?". Frostburg State University. Алынған 2007-11-24.
- ^ "carbon | Facts, Uses, & Properties". Britannica энциклопедиясы. Мұрағатталды from the original on 2017-10-24.
- ^ "carbon". Britannica encyclopedia.
- ^ а б c "Carbon – Naturally occurring isotopes". WebElements Periodic Table. Мұрағатталды from the original on 2008-09-08. Алынған 2008-10-09.
- ^ "History of Carbon". Архивтелген түпнұсқа on 2012-11-01. Алынған 2013-01-10.
- ^ Reece, Jane B. (31 October 2013). Campbell Biology (10 ed.). Pearson. ISBN 9780321775658.
- ^ а б "World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE)". Архивтелген түпнұсқа on 2001-05-31. Алынған 2008-10-09.
- ^ а б Chemistry Operations (December 15, 2003). "Carbon". Los Alamos National Laboratory. Архивтелген түпнұсқа on 2008-09-13. Алынған 2008-10-09.
- ^ Deming, Anna (2010). "King of the elements?". Nanotechnology. 21 (30): 300201. Бибкод:2010Nanot..21D0201D. дои:10.1088/0957-4484/21/30/300201. PMID 20664156.
- ^ Greenville Whittaker, A. (1978). "The controversial carbon solid−liquid−vapour triple point". Табиғат. 276 (5689): 695–696. Бибкод:1978Natur.276..695W. дои:10.1038/276695a0. S2CID 4362313.
- ^ Zazula, J. M. (1997). "On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam" (PDF). CERN. Мұрағатталды (PDF) from the original on 2009-03-25. Алынған 2009-06-06.
- ^ а б Greenwood and Earnshaw, pp. 289–292.
- ^ Greenwood and Earnshaw, pp. 276–8.
- ^ Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi (2003). "Materials: Ultrahard polycrystalline diamond from graphite". Табиғат. 421 (6923): 599–600. Бибкод:2003Natur.421..599I. дои:10.1038/421599b. PMID 12571587. S2CID 52856300.
- ^ Dienwiebel, Martin; Verhoeven, Gertjan; Pradeep, Namboodiri; Frenken, Joost; Heimberg, Jennifer; Zandbergen, Henny (2004). "Superlubricity of Graphite" (PDF). Physical Review Letters. 92 (12): 126101. Бибкод:2004PhRvL..92l6101D. дои:10.1103/PhysRevLett.92.126101. PMID 15089689. Мұрағатталды (PDF) from the original on 2011-09-17.
- ^ Deprez, N.; McLachan, D. S. (1988). "The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction". Journal of Physics D: Applied Physics. 21 (1): 101–107. Бибкод:1988JPhD...21..101D. дои:10.1088/0022-3727/21/1/015.
- ^ Collins, A. T. (1993). "The Optical and Electronic Properties of Semiconducting Diamond". Philosophical Transactions of the Royal Society A. 342 (1664): 233–244. Бибкод:1993RSPTA.342..233C. дои:10.1098/rsta.1993.0017. S2CID 202574625.
- ^ Delhaes, P. (2001). Graphite and Precursors. CRC Press. ISBN 978-90-5699-228-6.
- ^ а б c Unwin, Peter. "Fullerenes(An Overview)". Мұрағатталды from the original on 2007-12-01. Алынған 2007-12-08.
- ^ а б Ebbesen, T. W., ed. (1997). Carbon nanotubes—preparation and properties. Boca Raton, Florida: CRC Press. ISBN 978-0-8493-9602-1.
- ^ а б Dresselhaus, M. S.; Dresselhaus, G.; Avouris, Ph., eds. (2001). Carbon nanotubes: synthesis, structures, properties and applications. Topics in Applied Physics. 80. Berlin. ISBN 978-3-540-41086-7.
- ^ а б Nasibulin, Albert G.; Pikhitsa, P. V.; Jiang, H.; Brown, D. P.; Krasheninnikov, A. V.; Anisimov, A. S.; Queipo, P.; Moisala, A.; т.б. (2007). "A novel hybrid carbon material". Nature Nanotechnology. 2 (3): 156–161. Бибкод:2007NatNa...2..156N. дои:10.1038/nnano.2007.37. PMID 18654245. S2CID 6447122.
- ^ Nasibulin, A.; Anisimov, Anton S.; Pikhitsa, Peter V.; Jiang, Hua; Brown, David P.; Choi, Mansoo; Kauppinen, Esko I. (2007). "Investigations of NanoBud formation". Chemical Physics Letters. 446 (1): 109–114. Бибкод:2007CPL...446..109N. дои:10.1016/j.cplett.2007.08.050.
- ^ Vieira, R; Ledoux, Marc-Jacques; Pham-Huu, Cuong (2004). "Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C2H6/H2 over nickel catalyst". Applied Catalysis A: General. 274 (1–2): 1–8. дои:10.1016/j.apcata.2004.04.008.
- ^ а б Clifford, Frondel; Marvin, Ursula B. (1967). "Lonsdaleite, a new hexagonal polymorph of diamond". Табиғат. 214 (5088): 587–589. Бибкод:1967Natur.214..587F. дои:10.1038/214587a0. S2CID 4184812.
- ^ а б c Harris, PJF (2004). "Fullerene-related structure of commercial glassy carbons" (PDF). Philosophical Magazine. 84 (29): 3159–3167. Бибкод:2004PMag...84.3159H. CiteSeerX 10.1.1.359.5715. дои:10.1080/14786430410001720363. Архивтелген түпнұсқа (PDF) on 2012-03-19. Алынған 2011-07-06.
- ^ Rode, A. V.; Hyde, S. T.; Gamaly, E. G.; Elliman, R. G.; McKenzie, D. R.; Bulcock, S. (1999). "Structural analysis of a carbon foam formed by high pulse-rate laser ablation". Applied Physics A: Materials Science & Processing. 69 (7): S755–S758. Бибкод:1999ApPhA..69S.755R. дои:10.1007/s003390051522. S2CID 96050247.
- ^ а б c Heimann, Robert Bertram; Evsyukov, Sergey E. & Kavan, Ladislav (28 February 1999). Carbyne and carbynoid structures. Спрингер. pp. 1–. ISBN 978-0-7923-5323-2. Мұрағатталды from the original on 23 November 2012. Алынған 2011-06-06.
- ^ Lee, C.; Wei, X.; Kysar, J. W.; Hone, J. (2008). "Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene". Ғылым. 321 (5887): 385–8. Бибкод:2008Sci...321..385L. дои:10.1126/science.1157996. PMID 18635798. S2CID 206512830. Lay summary.
- ^ Sanderson, Bill (2008-08-25). "Toughest Stuff Known to Man : Discovery Opens Door to Space Elevator". nypost.com. Мұрағатталды from the original on 2008-09-06. Алынған 2008-10-09.
- ^ Jin, Zhong; Lu, Wei; O’Neill, Kevin J.; Parilla, Philip A.; Simpson, Lin J.; Kittrell, Carter; Tour, James M. (2011-02-22). "Nano-Engineered Spacing in Graphene Sheets for Hydrogen Storage". Chemistry of Materials. 23 (4): 923–925. дои:10.1021/cm1025188. ISSN 0897-4756.
- ^ Jenkins, Edgar (1973). The polymorphism of elements and compounds. Taylor & Francis. б. 30. ISBN 978-0-423-87500-3. Мұрағатталды from the original on 2012-11-23. Алынған 2011-05-01.
- ^ Rossini, F. D.; Jessup, R. S. (1938). "Heat and Free Energy of Formation of Carbon Dioxide and of the Transition Between Graphite and Diamond". Journal of Research of the National Bureau of Standards. 21 (4): 491. дои:10.6028/jres.021.028.
- ^ Grochala, Wojciech (2014-04-01). "Diamond: Electronic Ground State of Carbon at Temperatures Approaching 0 K". Angewandte Chemie International Edition. 53 (14): 3680–3683. дои:10.1002/anie.201400131. ISSN 1521-3773. PMID 24615828. S2CID 13359849.
- ^ Schewe, Phil & Stein, Ben (March 26, 2004). "Carbon Nanofoam is the World's First Pure Carbon Magnet". Physics News Update. 678 (1). Мұрағатталды from the original on March 7, 2012.
- ^ Itzhaki, Lior; Altus, Eli; Basch, Harold; Hoz, Shmaryahu (2005). "Harder than Diamond: Determining the Cross-Sectional Area and Young's Modulus of Molecular Rods". Angew. Хим. Int. Ed. 44 (45): 7432–5. дои:10.1002/anie.200502448. PMID 16240306.
- ^ "Researchers Find New Phase of Carbon, Make Diamond at Room Temperature". news.ncsu.edu. 2015-11-30. Мұрағатталды from the original on 2016-04-06. Алынған 2016-04-06.
- ^ Rabie, Passant (6 July 2020). "Astronomers Have Found The Source Of Life In The Universe". Inverse. Алынған 7 July 2020.
- ^ Marigo, Paola; т.б. (6 July 2020). "Carbon star formation as seen through the non-monotonic initial–final mass relation". Nature Astronomy. 152. arXiv:2007.04163. дои:10.1038/s41550-020-1132-1. S2CID 220403402. Алынған 7 July 2020.
- ^ а б c Hoover, Rachel (21 February 2014). "Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That". НАСА. Мұрағатталды from the original on 6 September 2015. Алынған 2014-02-22.
- ^ Lauretta, D.S.; McSween, H.Y. (2006). Meteorites and the Early Solar System II. Space science series. University of Arizona Press. б. 199. ISBN 978-0-8165-2562-1. Мұрағатталды from the original on 2017-11-22. Алынған 2017-05-07.
- ^ Mark, Kathleen (1987). Meteorite Craters. University of Arizona Press. ISBN 978-0-8165-0902-7.
- ^ "Online Database Tracks Organic Nano-Particles Across the Universe". Sci Tech Daily. February 24, 2014. Мұрағатталды from the original on March 18, 2015. Алынған 2015-03-10.
- ^ William F McDonough The composition of the Earth Мұрағатталды 2011-09-28 at the Wayback Machine жылы Majewski, Eugeniusz (2000). Earthquake Thermodynamics and Phase Transformation in the Earth's Interior. ISBN 978-0126851854.
- ^ Yinon Bar-On; т.б. (Jun 19, 2018). "The biomass distribution on Earth". PNAS. 115 (25): 6506–6511. дои:10.1073/pnas.1711842115. PMC 6016768. PMID 29784790.
- ^ Fred Pearce (2014-02-15). "Fire in the hole: After fracking comes coal". New Scientist. 221 (2956): 36–41. Бибкод:2014NewSc.221...36P. дои:10.1016/S0262-4079(14)60331-6. Мұрағатталды from the original on 2015-03-16.
- ^ "Wonderfuel: Welcome to the age of unconventional gas" Мұрағатталды 2014-12-09 at the Wayback Machine by Helen Knight, New Scientist, 12 June 2010, pp. 44–7.
- ^ Ocean methane stocks 'overstated' Мұрағатталды 2013-04-25 at the Wayback Machine, BBC, 17 Feb. 2004.
- ^ "Ice on fire: The next fossil fuel" Мұрағатталды 2015-02-22 at the Wayback Machine арқылы Fred Pearce, New Scientist, 27 June 2009, pp. 30–33.
- ^ Calculated from file global.1751_2008.csv in "Index of /ftp/ndp030/CSV-FILES". Архивтелген түпнұсқа on 2011-10-22. Алынған 2011-11-06. бастап Carbon Dioxide Information Analysis Center.
- ^ Rachel Gross (Sep 21, 2013). "Deep, and dank mysterious". New Scientist: 40–43. Мұрағатталды from the original on 2013-09-21.
- ^ Stefanenko, R. (1983). Coal Mining Technology: Theory and Practice. Society for Mining Metallurgy. ISBN 978-0-89520-404-2.
- ^ Kasting, James (1998). "The Carbon Cycle, Climate, and the Long-Term Effects of Fossil Fuel Burning". Consequences: The Nature and Implication of Environmental Change. 4 (1). Мұрағатталды from the original on 2008-10-24.
- ^ "Carbon-14 formation". Мұрағатталды from the original on 1 August 2015. Алынған 13 October 2014.
- ^ Aitken, M.J. (1990). Science-based Dating in Archaeology. pp. 56–58. ISBN 978-0-582-49309-4.
- ^ Nichols, Charles R. "Voltatile Products from Carbonaceous Asteroids" (PDF). UAPress.Arizona.edu. Архивтелген түпнұсқа (PDF) on 2 July 2016. Алынған 12 November 2016.
- ^ Gannes, Leonard Z.; Del Rio, Carlos Martı́nez; Koch, Paul (1998). "Natural Abundance Variations in Stable Isotopes and their Potential Uses in Animal Physiological Ecology". Comparative Biochemistry and Physiology – Part A: Molecular & Integrative Physiology. 119 (3): 725–737. дои:10.1016/S1095-6433(98)01016-2. PMID 9683412.
- ^ "Official SI Unit definitions". Мұрағатталды from the original on 2007-10-14. Алынған 2007-12-21.
- ^ Bowman, S. (1990). Interpreting the past: Radiocarbon dating. British Museum Press. ISBN 978-0-7141-2047-8.
- ^ Brown, Tom (March 1, 2006). "Carbon Goes Full Circle in the Amazon". Lawrence Livermore National Laboratory. Мұрағатталды from the original on September 22, 2008. Алынған 2007-11-25.
- ^ Libby, W. F. (1952). Radiocarbon dating. Chicago University Press and references therein.
- ^ Westgren, A. (1960). "The Nobel Prize in Chemistry 1960". Nobel Foundation. Мұрағатталды from the original on 2007-10-25. Алынған 2007-11-25.
- ^ "Use query for carbon-8". barwinski.net. Мұрағатталды from the original on 2005-02-07. Алынған 2007-12-21.
- ^ Watson, A. (1999). "Beaming Into the Dark Corners of the Nuclear Kitchen". Ғылым. 286 (5437): 28–31. дои:10.1126/science.286.5437.28. S2CID 117737493.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (1997). "The NUBASE evaluation of nuclear and decay properties" (PDF). Nuclear Physics A. 624 (1): 1–124. Бибкод:1997NuPhA.624....1A. дои:10.1016/S0375-9474(97)00482-X. Архивтелген түпнұсқа (PDF) on 2008-09-23.
- ^ Ostlie, Dale A. & Carroll, Bradley W. (2007). An Introduction to Modern Stellar Astrophysics. San Francisco (CA): Addison Wesley. ISBN 978-0-8053-0348-3.
- ^ Whittet, Douglas C. B. (2003). Dust in the Galactic Environment. CRC Press. pp. 45–46. ISBN 978-0-7503-0624-9.
- ^ Pikelʹner, Solomon Borisovich (1977). Star Formation. Спрингер. б. 38. ISBN 978-90-277-0796-3. Мұрағатталды from the original on 2012-11-23. Алынған 2011-06-06.
- ^ Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; т.б. (2000). "The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System". Ғылым. 290 (5490): 291–296. Бибкод:2000Sci...290..291F. дои:10.1126/science.290.5490.291. PMID 11030643. S2CID 1779934.
- ^ Smith, T. М .; Крамер, В.П .; Диксон, Р. К .; Лиманс, Р .; Нилсон, Р.П .; Соломон, А.М. (1993). «Әлемдік жердегі көміртегі айналымы». Су, ауа және топырақтың ластануы. 70 (1–4): 19–37. Бибкод:1993 WASP ... 70 ... 19S. дои:10.1007 / BF01104986. S2CID 97265068.
- ^ Берроуз, А .; Холман Дж .; Парсонс, А .; Пиллинг, Г .; Бағасы, Г. (2017). Химия3: Бейорганикалық, органикалық және физикалық химия. Оксфорд университетінің баспасы. б. 70. ISBN 978-0-19-873380-5. Мұрағатталды 2017-11-22 аралығында түпнұсқадан. Алынған 2017-05-07.
- ^ Левин, Джоэл С .; Аугустссон, Томми Р .; Натараджан, Мурали (1982). «Пребиологиялық палеатмосфера: тұрақтылық және құрамы». Биосфералар тіршілігінің пайда болуы және эволюциясы. 12 (3): 245–259. Бибкод:1982OrLi ... 12..245L. дои:10.1007 / BF00926894. PMID 7162799. S2CID 20097153.
- ^ Лоертинг, Т .; т.б. (2001). «Карбон қышқылының таңқаларлық кинетикалық тұрақтылығы туралы». Angew. Хим. Int. Ред. 39 (5): 891–895. дои:10.1002 / (SICI) 1521-3773 (20000303) 39: 5 <891 :: AID-ANIE891> 3.0.CO; 2-E. PMID 10760883.
- ^ Haldane J. (1895). «Көмірқышқыл оксидінің адамға әсері». Физиология журналы. 18 (5–6): 430–462. дои:10.1113 / jphysiol.1895.sp000578. PMC 1514663. PMID 16992272.
- ^ Горман, Д .; Дрюри, А .; Хуанг, Ю.Л .; Sames, C. (2003). «Көміртек оксидінің клиникалық токсикологиясы». Токсикология. 187 (1): 25–38. дои:10.1016 / S0300-483X (03) 00005-2. PMID 12679050.
- ^ «Көміртектің қосылыстары: көміртегі тотығы». Мұрағатталды түпнұсқасынан 2007-12-07 ж. Алынған 2007-12-03.
- ^ Байес, К. (1961). «Көміртегі тотығының фотолизі». Американдық химия қоғамының журналы. 83 (17): 3712–3713. дои:10.1021 / ja01478a033.
- ^ Андерсон Дж .; Розенфельд, Р.Н. (1991). «Көміртегі тотығының фотодиссоциациясы». Химиялық физика журналы. 94 (12): 7852–7867. Бибкод:1991JChPh..94.7857A. дои:10.1063/1.460121.
- ^ Сабин, Дж. Р .; Ким, Х. (1971). «Көміртек оксиді құрылымы мен қасиеттерін теориялық зерттеу». Химиялық физика хаттары. 11 (5): 593–597. Бибкод:1971CPL .... 11..593S. дои:10.1016/0009-2614(71)87010-0.
- ^ Moll N. G .; Резеңке D. R .; Томпсон В.Э. (1966). «Көміртек оксиді: оның өндірісі, инфрақызыл спектрі және құрылымы қатты СО матрицасында зерттелген2". Химиялық физика журналы. 45 (12): 4469–4481. Бибкод:1966JChPh..45.4469M. дои:10.1063/1.1727526.
- ^ а б Фатиади, Александр Дж.; Избелл, Гораций С .; Сагер, Уильям Ф. (1963). «Циклдық полигидроксиді кетондар. I. Гексагидроксибензолдың (бензенегексол) тотығу өнімдері» (PDF). Ұлттық стандарттар бюросының зерттеу журналы А бөлімі. 67А (2): 153–162. дои:10.6028 / jres.067A.015. PMC 6640573. PMID 31580622. Архивтелген түпнұсқа (PDF) 2009-03-25. Алынған 2009-03-21.
- ^ Полинг, Л. (1960). Химиялық облигацияның табиғаты (3-ші басылым). Итака, Нью-Йорк: Корнелл университетінің баспасы. б.93. ISBN 978-0-8014-0333-0.
- ^ Гринвуд және Эрншоу, 297–301 бб
- ^ Шербаум, Франц; т.б. (1988). «"Аурофилділік »Релятивистік эффекттің нәтижесі ретінде: Гексакис (трифенилфосфаноурио) метанының Дикциясы [(Ph3PAu)6C]2+". Angew. Хим. Int. Ред. Энгл. 27 (11): 1544–1546. дои:10.1002 / anie.198815441.
- ^ Риттер, Стивен К. «Көміртегіге алты байланыс: расталды». Химиялық және инженерлік жаңалықтар. Мұрағатталды түпнұсқасынан 2017-01-09 ж.
- ^ Ямашита, Макото; Ямамото, Йохсуке; Акиба, Кин-я; Хашизуме, Дайсуке; Ивасаки, Фужико; Такаги, Нозоми; Нагасе, Шигеру (2005-03-01). «Антрацен қаңқасын көтеретін гипервалентті пентакоординаттық көміртек және бор қосылыстарының синтездері мен құрылымдары - рентгендік анализ және DFT есептеу негізінде гипервалентті өзара әрекеттесуді анықтау». Американдық химия қоғамының журналы. 127 (12): 4354–4371. дои:10.1021 / ja0438011. ISSN 0002-7863. PMID 15783218.
- ^ Оксфордтың қысқаша ағылшын сөздігі, Оксфорд университетінің баспасы
- ^ «Қытайлықтар гауһар тасты бірінші рет қолданды». BBC News. 17 мамыр 2005 ж. Мұрағатталды түпнұсқадан 2007 жылғы 20 наурызда. Алынған 2007-03-21.
- ^ ван дер Крогт, Петр. «Карбоний / Көміртек - Элементимология және Элементтер Мультидикт». Мұрағатталды түпнұсқасынан 2010-01-23. Алынған 2010-01-06.
- ^ Ferchault de Réaumur, R.-A. (1722). L'art de convertir le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé (1956 жылғы ағылшын аудармасы). Париж, Чикаго.
- ^ «Көміртегі». Канада қосылады. Архивтелген түпнұсқа 2010-10-27. Алынған 2010-12-07.
- ^ Сенес, Фред. «Көміртекті кім ашты?». Фростбург мемлекеттік университеті. Мұрағатталды түпнұсқасынан 2007-12-07 ж. Алынған 2007-11-24.
- ^ Джолитти, Федерико (1914). Темір мен болатты цементтеу. McGraw-Hill Book Company, Inc.
- ^ Сенес, Фред (2000-09-09). «Кім көміртекті ашты». Фростбург мемлекеттік университеті. Мұрағатталды түпнұсқасынан 2007-12-07 ж. Алынған 2007-11-24.
- ^ Крото, Х.В .; Хит, Дж. Р .; О'Брайен, С. Керл, Р. Ф .; Smalley, R. E. (1985). «C60: Бакминстерфуллерене ». Табиғат. 318 (6042): 162–163. Бибкод:1985 ж.318..162K. дои:10.1038 / 318162a0. S2CID 4314237.
- ^ Фуллерендерді ашқаны үшін «Химия саласындағы Нобель сыйлығы 1996»"". Мұрағатталды түпнұсқасынан 2007-10-11 жж. Алынған 2007-12-21.
- ^ а б c USGS Minerals Yearbook: Графит, 2009 ж Мұрағатталды 2008-09-16 сағ Wayback Machine және графит: Минералды шикізаттың қысқаша сипаттамалары 2011 ж
- ^ Харлоу, Г.Э. (1998). Гауһар тастардың табиғаты. Кембридж университетінің баспасы. б. 223. ISBN 978-0-521-62935-5.
- ^ Кателле, В.Р. (1911). Гауһар. Джон Лейн компаниясы. б. 159. Үндістандағы және басқа жерлердегі аллювиалды гауһар тастар туралы пікірталас, сондай-ақ алғашқы олжалар
- ^ Доп, В. (1881). Гауһар тастар, алтын және көмір Үндістан. Лондон, Truebner & Co. Болл Британдық қызметте геолог болды. I тарау, 1 бет
- ^ Херши, Дж. В. (1940). Алмастар кітабы: олардың қызықты тарихы, қасиеттері, сынақтары және синтетикалық өндіріс. Kessinger Pub Co. б. 28. ISBN 978-1-4179-7715-4.
- ^ а б Janse, A. J. A. (2007). «1870 жылдан бастап гауһардың гауһар өндірісі». Асыл тастар және гемология. XLIII (2007 ж.): 98–119. дои:10.5741 / GEMS.43.2.98.
- ^ а б Лоренц, В. (2007). «Батыс Австралиядағы Аргайл: әлемдегі ең бай диамантивтік құбыр; оның өткені мен болашағы». Gemmologie, Zeitschrift der Deutschen Gemmologischen Gesellschaft. 56 (1/2): 35–40.
- ^ «Монтанада микроскопиялық гауһар табылды». Монтана стандарты. 2004-10-17. Архивтелген түпнұсқа 2005-01-21. Алынған 2008-10-10.
- ^ Кука, Сара (2004-10-19). «Монтанада табылған микроскопиялық алмас». Livescience.com. Архивтелген түпнұсқа 2008-07-05. Алынған 2008-09-12.
- ^ «Delta News / пресс-релиздер / басылымдар». Deltamine.com. Архивтелген түпнұсқа 2008-05-26. Алынған 2008-09-12.
- ^ Маршалл, Стивен; Шор, Джош (2004-10-22). «Алмас өмір». Партизандық жаңалықтар желісі. Архивтелген түпнұсқа 2008-06-09. Алынған 2008-10-10.
- ^ Кантвелл, В. Дж .; Мортон, Дж. (1991). «Композициялық материалдардың соққыға төзімділігі - шолу». Композиттер. 22 (5): 347–62. дои:10.1016 / 0010-4361 (91) 90549-V.
- ^ Холтзаффел, Ч. (1856). Механикалық манипуляция. Чарльз Холтзаффель. Интернет мұрағаты Мұрағатталды 2016-03-26 сағ Wayback Machine
- ^ «Алмастың өндірістік статистикасы және ақпараты». Америка Құрама Штаттарының геологиялық қызметі. Мұрағатталды түпнұсқасынан 2009-05-06. Алынған 2009-05-05.
- ^ Коэльо, Р. Т .; Ямада, С .; Аспинвол, Д.К .; Дана, M. L. H. (1995). «Алюминий негізіндегі қорытпаларды бұрғылау және қайта өңдеу кезінде поликристалды гауһар (ПКД) инструменталды материалдарын қолдану». Станок жасау және өндіріс жөніндегі халықаралық журнал. 35 (5): 761–774. дои:10.1016/0890-6955(95)93044-7.
- ^ Харрис, Д.С (1999). Инфрақызыл терезелер мен күмбездерге арналған материалдар: қасиеттері мен өнімділігі. SPIE түймесін басыңыз. 303–334 бет. ISBN 978-0-8194-3482-1.
- ^ Нусинович, Г.С (2004). Гиротрондар физикасымен таныстыру. JHU Press. б. 229. ISBN 978-0-8018-7921-0.
- ^ Сакамото, М .; Эндриз, Дж. Г. Scifres, D. R. (1992). «Алмас радиаторына орнатылған монолитті AlGaAs (800 нм) лазерлік диодты массивтен 120 Вт қуаттылық қуаты». Электрондық хаттар. 28 (2): 197–199. Бибкод:1992ElL .... 28..197S. дои:10.1049 / ел: 19920123.
- ^ Дорфер, Леопольд; Мозер, М .; Шпиндлер, К .; Бахр, Ф .; Эгартер-Вигль, Э .; Дор, Г. (1998). «Орталық Еуропадағы 5200 жылдық акупунктура?». Ғылым. 282 (5387): 242–243. Бибкод:1998Sci ... 282..239D. дои:10.1126 / ғылым.282.5387.239f. PMID 9841386. S2CID 42284618.
- ^ Дональдсон, К .; Стоун, V .; Клутер, А .; Ренвик, Л .; MacNee, W. (2001). «Ультра жіңішке бөлшектер». Кәсіптік және экологиялық медицина. 58 (3): 211–216. дои:10.1136 / oem.58.3.211. PMC 1740105. PMID 11171936.
- ^ Көміртекті нанобөлшектер ересектерге жеміс шыбындары үшін зиянды, бірақ жас үшін жақсы Мұрағатталды 2011-11-02 Wayback Machine ScienceDaily (17 тамыз, 2009)
- ^ «Пресс-релиз - Титаник апаты: жаңа теория көмірдің өртенуіне септігін тигізеді». www.geosociety.org. Мұрағатталды түпнұсқасынан 2016-04-14. Алынған 2016-04-06.
- ^ Макшерри, Патрик. «Көмір бункеріндегі өрт». www.spanamwar.com. Мұрағатталды түпнұсқасынан 2016-03-23. Алынған 2016-04-06.
Библиография
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Элементтер химиясы (2-ші басылым). Баттеруорт-Хейнеманн. ISBN 978-0-08-037941-8.



