Атомдық көміртек - Atomic carbon - Wikipedia
| Атаулар | |
|---|---|
| IUPAC атауы Атомдық көміртек | |
| IUPAC жүйелік атауы Метанедиилиден (алмастырғыш) Көміртек (қоспа) | |
| Идентификаторлар | |
3D моделі (JSmol ) | |
| Чеби | |
| ChemSpider | |
| ECHA ақпарат картасы | 100.028.321 |
PubChem CID | |
CompTox бақылау тақтасы (EPA) | |
| |
| |
| Қасиеттері | |
| C | |
| Молярлық масса | 12.011 г · моль−1 |
Өзгеше белгіленбеген жағдайларды қоспағанда, олар үшін материалдар үшін деректер келтірілген стандартты күй (25 ° C [77 ° F], 100 кПа). | |
| Infobox сілтемелері | |
Атомдық көміртек, жүйелі түрде аталды көміртегі және λ0-метанмонокөміртегі деп те аталады, түссіз газ тәрізді бейорганикалық химиялық бірге химиялық формула C ([C] да жазылған). Ол қоршаған ортаның температурасы мен қысымында кинетикалық тұрақсыз, оны автополимеризациялау арқылы алып тастайды.
Атомдық көміртек - бұл көміртектің қарапайым түрі, сонымен қатар көміртек кластерінің бастауы. Сонымен қатар, оны графит мономері деп санауға болады.
Номенклатура
The тривиальды атау монокөміртегі ең көп қолданылатын және болып табылады IUPAC атауы. Жүйелік атау көміртегі, жарамды IUPAC атауы, композициялық номенклатура бойынша құрастырылған. Алайда композициялық атау ретінде ол таза көміртектің әртүрлі формаларын ажыратпайды. Жүйелік атау λ0-метан, сондай-ақ жарамды IUPAC атауы алмастырушы номенклатура бойынша жасалған. Бірге монокөміртегі, бұл атау титулдық қосылысты ажыратады, өйткені олар молекула туралы құрылымдық ақпаратты қолдану арқылы алынған. Оның құрылымын жақсы көрсету үшін бос атом көміртегі көбінесе [C] түрінде жазылады. λ2-метилий ([CH]+
) болып табылады ион пайдасының нәтижесінде пайда болады H+
атомдық көміртегі арқылы
Қасиеттері
Амфотерия
A Льюис қышқылы атомдық көміртектің электрон жұбымен, ал Льюис негізінің электрон жұбы аддукция бойынша атом көміртегімен қосыла алады:[1]
- : [C] + M → [MC]
- [C] +: L → [CL]
Осы донорлықтың немесе аддукцияланған электрон жұбын қабылдағандықтан, атом көміртегі Льюис амфотерлік сипатқа ие.[2] Атомдық көміртектің Льюис қышқылдарына екі жұпқа дейін немесе Льюис негіздерінен екі жұпқа дейін қабылдай алатын қабілеті бар.
Протон протондау арқылы атом көміртегімен қосыла алады:
- C + H+
→ CH+
Протонды ұстап алғандықтан (H+
), атомдық көміртегі және оның Льюис негіздерінің қосындылары, мысалы, судың негізгі сипаттамасы Бренстед-Лоури болып табылады. Атомдық көміртектің конъюгат қышқылы λ2-метилий (CH+
).
- H
3O+
+ C ⇌ H
2O + CH+
Қоспалардың сулы ерітінділері көміртегі орталығы мен λ гидратациясына байланысты тұрақсыз2produce өндіруге арналған метилий тобы2-метанол (CHOH) немесе λ2-метан (CH
2), немесе гидроксиметилий (CH
2OH+
) сәйкесінше топтар.
- H
2O + C → CHOH - H
2O + CH+
→ CH
2OH+
Λ2-қосымша метанол тобы изомерия түзуі мүмкін формальдегид, немесе қалыптастыру үшін одан әрі гидратталған болуы керек метендиол. Қоспалардағы гидроксиметилий тобы ықтимал әрі қарай гидратталып, дигидроксиметилий түзе алады (CH (OH)+
2), немесе формилий түзу үшін сумен тотықтырылады (HCO+
).[1]
Электромагниттік қасиеттері
Атом көміртегіндегі электрондар атомдық орбитальдар арасында aufbau принципі бойынша бөлінеді, сәйкес энергия деңгейлерімен бірегей кванттық күйлер пайда болады. Энергия деңгейі ең төмен немесе негізгі күй - бұл үштік дириадикалық күй (3P0). Қуаты жағынан салыстырмалы түрде жақын орналасқан алғашқы екі қозған күй - сингл (1Д.2) және синглет дирадикал (1S0). Атомдық көміртектің радикалды емес күйі жүйелі түрде λ деп аталады2-метилиден, ал негізгі күйді қамтитын дирадикалы күйлер көміртек (2 •) немесе λ деп аталады2-метанды 1Д.2 және 1S0 күйлер 121,9 кДж моль−1 және 259,0 кДж моль−1 сәйкесінше негізгі күйден жоғары. Осы үш күй арасындағы ауысуларға спинді айналдыру және немесе электронды жұптастыру қажеттілігіне байланысты формальды түрде тыйым салынады. Бұл дегеніміз, электромагниттік спектрдің инфрақызыл аймағындағы 981,1 нм-дағы атомдық көміртекті фосфордың мөлшері. Ол ультракүлгін сәулелермен қозған кезде сәйкесінше 873,0 нм және 461,9 нм-де көк аймақта инфрақызыл және фосфорлық флуоресцирлеу мүмкін.
Атом көміртегінің әр түрлі күйлері әртүрлі химиялық әрекеттерді көрсетеді. Мысалы, триплет радикалының радикалды емес түрлерімен реакциялары абстракцияны қамтиды, ал радикалды емес синглеттің реакциялары тек абстракцияны ғана емес, сонымен қатар оны енгізу арқылы қосады.
- [C]2•(3P0) + H
2O → [CHOH] → [CH] + [HO] - [C] (1Д.2) + H
2O → [CHOH] → CO + H
2 немесе H
2CO
Өндіріс

Бұл өте қысқа өмір сүретін түрі электр доғасын туғызып, екі іргелес көміртекті таяқшадан үлкен ток өткізіп жасайды. Процесс барысында атом көміртегі түзіледі. Профессор Фил Шевлин саласындағы негізгі жұмыстарды негізге алды Оберн университеті АҚШ-та.
Бұл түрді жасау тәсілі фуллерендердің пайда болуымен тығыз байланысты C60, басты айырмашылығы - атомдық көміртектің түзілуінде вакуум әлдеқайда төмен.
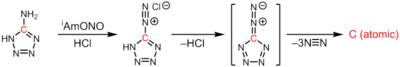
Атомдық көміртек 3 эквивалент динитроген экструзиясы кезінде 5-диазотетразолдың термолизінде түзіледі:[3]
CN6 →: C: + 3N2
Негізінде атомдық көміртектің таза көзін алуға болады термиялық ыдырау туралы тантал карбиді. Дамыған ақпарат көзінде[4] көміртегі жұқа қабырғаларға салынған тантал түтік. Тығыздалғаннан кейін оны тікелей қыздырады электр тоғы. Көміртектің сольватталған атомдары түтіктің сыртқы бетіне таралады және температура көтерілгенде тантал түтігінің бетінен атомдық көміртектің булануы байқалады. Қайнар көзі ешқандай қосымша түрдің қатысуынсыз таза көміртек атомдарын қамтамасыз етеді.
Көміртек тотығының декарбонилденуі
Атомдық көміртекті көміртегі тотығы арқылы өндіруге болады декарбонилдену. Бұл процесте, көміртегі тотығы атомдық көміртекті түзуге ыдырайды және көміртегі тотығы теңдеу бойынша:
- C
3O
2 → 2 CO + [C]
Процесс қамтиды дикарбон тотығы аралық ретінде және екі кезеңде жүреді. Екі декарбонилдену үшін фотолитикалық алыс ультрафиолет сәулеленуі қажет.
- OCCCO → [CCO] + CO
- [CCO] → CO + [C]
Қолданады
Әдетте, атом көміртегінің үлгісі термодинамикалық тепе-теңдіктегі негізгі күйден басқа қозған күйлердің қоспасы түрінде болады. Әр мемлекет болуы мүмкін реакция механизмдеріне әр түрлі үлес қосады. Қандай күйге енетінін анықтау үшін қолданылатын қарапайым тест - триплет күйінің О-мен диагностикалық реакциясын қолдану2, егер реакция шығымы өзгермеген болса, онда сингл күйі қатысатынын көрсетеді. Әдетте, дирадикалық негізгі күй абстракция реакцияларына түседі. Атомдық көміртек «шын» алу үшін қолданылған карбендер абстракциясы бойынша оттегі атомдары карбонил топтар:
- R2C = O +: C: → R2C: + CO
Осылайша түзілген карбендер нағыз карбендік мінез-құлықты көрсетеді. Диазо қосылыстары сияқты басқа әдістермен дайындалған карбендер карбеннің өзіне емес, карбен жасау үшін қолданылатын диазо қосылысына (карбеннің мінез-құлқын имитациялайтын) жақсырақ қасиеттерді көрсете алады. Бұл механикалық тұрғыдан карбеннің мінез-құлық перспективасын түсінуден маңызды.
Реакциялар
Атомдық көміртегі электрондардың жетіспейтін түрі болғандықтан, ол өздігінен таза күйінде автополимерленеді немесе Льюис қышқылымен немесе негізімен өңделгенде қоспаға айналады. Атом көміртегінің тотығуы көміртек тотығын, ал тотықсыздану λ береді2-метан.Бейметалдар, оның ішінде оттегі, екі валентті көміртекті қосылыстар түзе отырып, атом көміртегіне қатты әсер етеді:
- 2 [C] + O
2 → 2 CO
Атомдық көміртегі реактивті, реакциялардың көпшілігі өте экзотермиялық. Олар негізінен газ фазасында сұйық азот температурасында (77 К) жүзеге асырылады. Органикалық қосылыстармен жүретін типтік реакцияларға мыналар жатады:[5]
- Карбоны түзу үшін алкандарда С-Н байланысына енгізу
- Кетондар мен альдегидтердегі карбоксил топтарының оксигенизациясы нәтижесінде карбен, 2-бутанил түзетін 2-бутанон пайда болады.
- Циклопропилиденді қалыптастыру үшін көміртек-көміртекті қос байланыстарға енгізу, сақиналық саңылауға ұшырайды, қарапайым мысал - алкуленге кумуленді қалыптастыру.
Суды О-Н байланысына енгізгенде формальдегидке қайта оралатын H-C-OH карбині түзіледі, HCHO.
Әдебиеттер тізімі
- ^ а б Хусейн, Д .; Кирш, Л. Дж. (1 қаңтар 1971). «Атомдық көміртектің реакциясы С (2.)3PДж) Ультра күлгін вакуумдағы кинетикалық сіңіру спектроскопиясы ». Фарадей қоғамының операциялары. 67: 2025–2035. дои:10.1039 / TF9716702025.
- ^ Хаусрофт, Кэтрин Э .; Шарп, Алан Г. (2012). «Сулы ерітіндідегі қышқылдар, негіздер және иондар». Бейорганикалық химия (4-ші басылым). Pearson Education, Ltd. б. 227. ISBN 978-0-273-74275-3.
- ^ Шевлин, Филипп Б. (2002-05-01). «5-тетразолилдиазоний хлоридінің ыдырауындағы атомдық көміртектің түзілуі». Американдық химия қоғамының журналы. 94 (4): 1379–1380. дои:10.1021 / ja00759a069.
- ^ Краснокутский, С.А .; Huisken, F. (15 қыркүйек 2014). «Төмен энергиялы атомдық көміртектің қарапайым және таза көзі». Қолданбалы физика хаттары. 105 (11): 113506. Бибкод:2014ApPhL.105k3506K. дои:10.1063/1.4895806.
- ^ Аралық химия, Роберт А. Мосс, Мэттью С. Платц және Мейтланд Джонс кіші, Уили-Блэквелл, (2004), ISBN 978-0471233244
Бұл мақалада жалпы тізімі бар сілтемелер, бірақ бұл негізінен тексерілмеген болып қалады, өйткені ол сәйкесінше жетіспейді кірістірілген дәйексөздер. (Қыркүйек 2010) (Бұл шаблон хабарламасын қалай және қашан жою керектігін біліп алыңыз) |
Әрі қарай оқу
- Уайт Дж .; Пэдман Р. (1991). «Жұлдызаралық ортадағы атомдық көміртектің бейнелері». Табиғат. 354 (6354): 511–513. Бибкод:1991 ж.354..511W. дои:10.1038 / 354511a0. S2CID 4262147.
- Шевлин П. (1972). «5-тетразойлдиазоний хлоридінің ыдырауындағы атомдық көміртектің түзілуі». Дж. Хим. Soc. 94 (4): 1379–1380. дои:10.1021 / ja00759a069.
- Шевлин П. (1980). «Атом көміртегінің алынуы және реакциясы». Р.А.Абрамовичте (ред.) Реактивті аралық өнімдер. 1. Нью-Йорк: Пленумдық баспасөз. б. 1.
- M. J. S. Dewar; Д. Дж. Нельсон; Шевлин П. K. A. Biesida (1981). «Карбонилді қосылыстарды атомдық көміртекпен тотықсыздандыру механизмін эксперименттік және теориялық зерттеу». Дж. Хим. Soc. 103 (10): 2802. дои:10.1021 / ja00400a052.
- Биесиада, Кит А .; Шевлин, Филипп Б. (1984). «Карбонил қосылысын атом көміртегімен тотықсыздандырғанда аралықты молекулалық ұстау». Органикалық химия журналы. 49 (6): 1151. дои:10.1021 / jo00180a047.
- Мосс, Роберт А; Джонс, Мейтланд (2004). «Атом көміртегі». Реактивті аралық химия. бет.463–500. ISBN 978-0-471-23324-4.
