Анкилостомильді инфекция - Hookworm infection
| Анкилостомильді инфекция | |
|---|---|
| Басқа атаулар | Анкилостомиль ауруы |
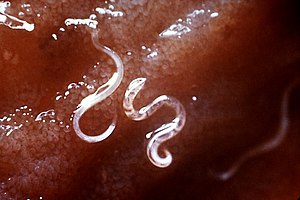 | |
| Анкилостормалар | |
| Мамандық | Жұқпалы ауру |
| Белгілері | Қышу, локализацияланған бөртпе, іштің ауыруы, диарея[1] |
| Асқынулар | Анемия, ақуыз жетіспеушілігі[2] |
| Себептері | Анцилостома он екі елі ішек (ескі әлем анкилостомасы), Американдық некатор (жаңа әлем анкилостомасы)[1] |
| Тәуекел факторлары | Жалаң аяқ ішке кіру жылы климат кедейлермен санитарлық тазалық[1] |
| Диагностикалық әдіс | Нәжістің үлгісі[1] |
| Алдын алу | Жалаң аяқ жүрмеу, тоқтау сыртқы дәрет[1] |
| Дәрі-дәрмек | Албендазол, мебендазол, темір қоспалары[3] |
| Жиілік | 428 млн (2015)[4] |
Анкилостомильді инфекция түрі бойынша инфекция болып табылады ішек паразиті а ретінде белгілі анкилостомид.[1][5] Бастапқыда инфекция орнында қышу және бөртпе пайда болуы мүмкін.[1] Бірнеше құрттан зардап шеккендерге симптомдар байқалмауы мүмкін.[1] Көптеген құрттарды жұқтырған адамдар бастан кешуі мүмкін іш ауруы, диарея, салмақ жоғалту және шаршау.[1] Балалардың психикалық және физикалық дамуына әсер етуі мүмкін.[1] Анемия әкелуі мүмкін.[1]
Адамдарда анкилостомиланың екі кең таралған инфекциясы бар анкилостомиоз және некаториоз, түр тудырады Анцилостома он екі елі ішек және Американдық некатор сәйкесінше.[1] Анкилосторманың жұмыртқалары ауруға шалдыққан адамдардың нәжісіне түседі.[1] Егер бұлар қоршаған ортаға түсіп кетсе, олар еніп кетуі мүмкін личинкалар (жетілмеген құрттар), олар теріге ене алады.[1] Бір түрі ластанған тамақ арқылы да таралуы мүмкін.[1] Тәуекел факторларына жаяу жүру жатады жалаң аяқ жылы климатта, қайда санитарлық тазалық кедей.[1] Диагностика а нәжіс үлгісі а микроскоп.[1]
Ауру кең таралған жерлерде жалаңаяқ жүрмеу арқылы аурудың жеке деңгейінде алдын алуға болады.[1] Халық деңгейінде, төмендеу сыртқы дәрет сияқты шикі нәжісті қолданбау тыңайтқыш, және жаппай дегельминтизация тиімді болып табылады.[1] Емдеу әдетте дәрі-дәрмектермен жүргізіледі албендазол немесе мебендазол бір-үш күнге.[3] Темір қоспалары анемиясы бар адамдарға қажет болуы мүмкін.[3]
Анкилостомиялар 2015 жылы шамамен 428 миллион адамға жұқтырған.[4] Ауыр инфекциялар балаларда да, ересектерде де болуы мүмкін, бірақ ересектерде сирек кездеседі.[2] Олар сирек өліммен аяқталады.[6] Анкилостомильді инфекция а топырақ арқылы берілетін гельминтоз және а ретінде жіктелген тропикалық ауру ескерілмеген.[7]
Белгілері мен белгілері
Анкилостомиданың инфекциясы үшін ешқандай белгілер мен белгілер тән емес, бірақ олар ішектің тіркесімін тудырады қабыну және прогрессивті темір тапшылығы анемиясы және ақуыз жетіспеушілігі. Жөтелу, кеудедегі ауырсыну, ысқырықты безгегі және температура кейде қатты инфекциядан туындайды. Эпигастрийдегі ауырсыну, ас қорыту, жүрек айну, құсу, іш қату, және диарея ерте немесе кейінгі кезеңдерде де болуы мүмкін, бірақ асқазан-ішек жолдарының белгілері уақыт өте келе жақсарады. Жетілдірілген ауыр инфекцияның белгілері анемия және ақуыз жетіспеушілігі, соның ішінде арықтау, жүрек жеткіліксіздігі, және іштің кеңеюі асцит.
Личинка басып кіру тері (көбінесе Америкада) деп аталатын тері ауруын тудыруы мүмкін тері личинкалары сонымен қатар серпінді атқылау деп аталады. Бұл құрттардың иелері адам емес және дернәсілдер терінің үстіңгі бес қабатына ене алады, сонда олар қарқынды, жергілікті пайда болады. қышу, әдетте аяқпен немесе төменгі аяқпен, белгілі жер қышуы. Бұл инфекция дернәсілдерге байланысты A. braziliense анкилостомид. Дернәсілдер бұралмалы туннельдермен қоныс аударады қабат қабаты және мүйізді қабат терінің пайда болуы серпигинді везикулярлы зақымдану. Дернәсілдердің алға жылжуымен зақымданудың артқы бөліктері құрғақ және қыртысты болады. Зақымданулар әдетте қатты қышиды.[8]
Инкубация мерзімі
Инкубациялық кезең бірнеше аптадан бірнеше айға дейін өзгеруі мүмкін және бұл көбінесе жеке адам жұқтырған анкилостомит паразиттерінің санына байланысты.[9]
Себеп

Адамдарда анкилостомильді инфекцияға жатады анкилостомиоз және некаториоз. Анцилостомоздың себебі болып табылады Анцилостома он екі елі ішек, ішінде кездесетін кең таралған түрі болып табылады Таяу Шығыс, Солтүстік Африка, Үндістан, және (бұрын) in оңтүстік Еуропа. Некаториоз Американдық некатор, жылы неғұрлым кең таралған түрі Америка, Сахарадан оңтүстік Африка, Оңтүстік-Шығыс Азия, Қытай, және Индонезия.[дәйексөз қажет ]
Сияқты басқа жануарлар құстар, иттер, және мысықтар әсер етуі мүмкін. A. tubaeforme мысықтарды жұқтырады, A. caninum иттерді жұқтырады және A. braziliense және Uncinaria stenocephala мысықтарды да, иттерді де жұқтырыңыз. Осы инфекциялардың кейбіреулері болуы мүмкін адамдарға беріледі.[10]
Морфология
A. duodenale құрттар сұр немесе ақ немесе қызғылт түсті, денесі дененің қалған бөлігіне қатысты сәл бүгілген. Бұл иілу алдыңғы жағында анкилостомидтер аталған нақты ілмек формасын құрайды. Олардың екі жұп тістері бар жақсы дамыған ауыздары бар. Еркектер шамамен бір сантиметрді 0,5 миллиметрге өлшейтін болса, аналықтары көбінесе ұзын және қатал. Сонымен қатар, еркектерді әйелдерден айыруға болады, олар артқы копуляторлы бурсаның болуына байланысты.[11]
N. americanus морфологиясы бойынша өте ұқсас A. duodenale. N. americanus әдетте қарағанда кіші A. duodenale әдетте ерлердің ұзындығы 5-тен 9 мм-ге дейін, ал әйелдер ұзындығы шамамен 1 см. Ал A. duodenale екі жұп тістері бар, N. americanus буккал капсуласында кесетін жұп табақшаларға ие. Сонымен қатар, ілмек формасы әлдеқайда айқындалған Некатор қарағанда Анцилостома.[11]
Өміршеңдік кезең
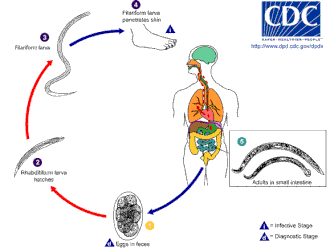
Анкилостометра 18 ° C-тан жоғары жылы топырақта жақсы дамиды. Олар, ең алдымен, бар құмды немесе сазды топырақ және өмір сүре алмайды саз немесе Muck. Жауын-шашын орташа өмір сүру үшін жылына 1000 мм-ден (40 дюйм) артық болуы керек. Осы жағдайлар болған жағдайда ғана жұмыртқалар шыға алады. Жұқпалы дернәсілдері N. americanus жоғары температурада өмір сүре алады, ал олар A. duodenale салқын климатқа жақсы бейімделген. Әдетте, олар табиғи жағдайда ең көп дегенде бірнеше апта ғана өмір сүреді және тікелей күн сәулесінің әсерінен немесе бірден өледі құрғау.[дәйексөз қажет ]
Хосттың инфекциясы жұмыртқа емес, дернәсілдер арқылы жүреді. Әзірге A. duodenale ішуге болады, әдеттегі инфекция әдісі тері арқылы жүреді; бұл көбінесе жаяу жүруден туындайды жалаң аяқ нәжіспен ластанған жерлер арқылы. Дернәсілдер аяқтың терісіне еніп, денеге енгеннен кейін, олар арқылы қозғалады тамыр жүйесі дейін өкпе, және сол жерден трахея және жұтып қойды. Содан кейін олар өңеш ішіндегі саяхатын аяқтап, ас қорыту жүйесіне кіріңіз ішек, онда личинкалар ересек құрттарға айналады.[12][13]
Хост ішегінде болғаннан кейін, Некатор ұзаққа созылатын инфекцияны қоздырады, әдетте 1 жылдан 5 жылға дейін (көптеген құрттар жұқтырғаннан кейін бір-екі жыл ішінде өледі), дегенмен кейбір ересек құрттар 15 немесе одан да көп жыл өмір сүретіні жазылған. Анцилостома ересектер қысқа өмір сүреді, орташа есеппен 6 ай ғана өмір сүреді. Алайда инфекцияны ұзаққа созуға болады, өйткені ұйқыдағы дернәсілдерді мерзімі өткен ересек құрттардың орнына көптеген жылдар бойы тіндік «дүкендерден» (жоғарыдағы Патологияны қараңыз) «кезекпен» алуға болады. Бұл инфекцияның таралуы мен қарқындылығының маусымдық ауытқуын тудыруы мүмкін (таралу кезіндегі қалыпты маусымдық өзгерістерден басқа).

Олар иесінің ішінде жұптасады, әйелдер күніне 30 000-ға дейін жұмыртқа салады, ал тірі кезінде нәжіспен бөлінетін 18-44 миллионға дейін жұмыртқа салады. Ересек құрттардың жетілуі, жұптасуы және жұмыртқа түзуі үшін 5 - 7 апта қажет болғандықтан, өте ауыр инфекцияның алғашқы кезеңінде науқастың нәжісінде жұмыртқа анықталмай өткір белгілер пайда болуы мүмкін. Бұл диагнозды өте қиынға соғуы мүмкін.
N. americanus және A. duodenale жұмыртқаны жылы, ылғалды топырақта табуға болады, ол жерде олар бірінші сатыдағы личинкаларға немесе L1-ге шығады. Инфекциялық емес рабдитоформаның қоректену кезеңі L1 топырақ микробтарымен қоректеніп, ақырында екінші сатыдағы дернәсілдерге айналады, L2, ол да рабдитоформ сатысында. Ол шамамен 7 күн тамақтанады, содан кейін үшінші сатыдағы дернәсілдерге немесе L3-ге айналады. Бұл паразиттің филариформды кезеңі, яғни дернәсілдердің қоректенбейтін инфекциялық түрі. L3 дернәсілдері өте қозғалмалы және адам иесінің терісіне ену мүмкіндігін жоғарылату үшін жоғары жерлер іздейді. L3 дернәсілдері иесін таппай 2 аптаға дейін тіршілік ете алады. Әзірге N. americanus дернәсілдер терінің енуімен ғана жұғады, A. duodenale ену арқылы да, ауызша да жұқтыруы мүмкін. L3 дернәсілдері иесіне сәтті енгеннен кейін, олар тері астындағы венулалар мен адам иесінің лимфа тамырлары арқылы жүреді. Ақырында L3 дернәсілдері өкпе капиллярлары арқылы өкпеге еніп, альвеолаларға бөлінеді. Содан кейін олар трахеямен өтіп, үй иесі жөтеліп, жұтылады. Жұтылғаннан кейін L3 личинкалары аш ішекте кездеседі, олар L4 немесе ересек құрт сатысында балқып кетеді. Терінің енуінен ересек адамның дамуына дейінгі барлық процесс шамамен 5-9 аптаға созылады. Ересек аналық құрттар жұмыртқаны босатады (N. americanus күніне шамамен 9000–10000 жұмыртқа және A. duodenale Адам иесінің нәжісімен өтетін 25000–30000 жұмыртқа / тәулігіне). Бұл жұмыртқалар қоршаған ортада бірнеше күн ішінде пайда болады және цикл жаңадан басталады.[12][14][15]
Патофизиология
Анкилостомильді инфекция әдетте асимптоматикалық болып саналады, бірақ 1962 жылы Норман Столл сипаттағандай, бұл өте қауіпті инфекция, себебі оның зияны «үнсіз және жасырын».[16] Жеке адам инфекциядан кейін көп ұзамай жалпы белгілерді сезінуі мүмкін. Паразиттік ену және ену орнында аллергиялық реакция болып табылатын жер қышуы, жұқтырған науқастарда жиі кездеседі N. americanus.[11] Сонымен қатар, жөтел және пневмонит нәтижесінде дернәсілдер ене бастайды альвеолалар және трахеямен жүріңіз. Содан кейін личинкалар иесінің жіңішке ішегіне жетіп, жетіле бастағаннан кейін, ауру адам диареяға және басқа да асқазан-ішек жолдарының ыңғайсыздықтарына ұшырайды.[11] Дегенмен, Столл айтқан «үнсіз және арамза» белгілер созылмалы, ауыр интенсивті анкилостоминфекцияға қатысты. Анкилостомиданың инфекциясымен байланысты негізгі ауру ішектің қан жоғалтуынан, темір тапшылығы анемиясынан және ақуыздың тамақтанбауынан туындайды.[14] Олар негізінен жіңішке ішектегі ересек анкилостормалардан қанды жұту, жарылу нәтижесінде пайда болады эритроциттер және қадір-қасиетін төмендетеді гемоглобин хостта.[12] Бұл ұзақ мерзімді қан жоғалту физикалық түрде бет және перифериялық көріністер арқылы көрінуі мүмкін ісіну; эозинофилия және антифризді жұқтырған кейбір науқастар темір тапшылығы анемиясынан туындаған пиканы сезінеді.[11] Жақында анкилостоминфекцияның денсаулық сақтауында үлкен рөл атқаратын басқа маңызды нәтижелеріне көп көңіл бөлінуде. Қазіргі кезде анкилостомияның созылмалы инфекциясынан зардап шегетін балалар өсудің тежелуімен қатар интеллектуалды және когнитивті бұзылулардан зардап шегуі мүмкін екендігі кеңінен қабылданды.[12][17] Сонымен қатар, жақында жүргізілген зерттеулер аналық жүктілік кезінде аналық құрт жұқтырған кезде ана мен ұрықтың жағымсыз нәтижелерінің әлеуетіне бағытталған.
Ауру нематодтық құрттармен байланысты болды (Анкилостома дуоденалисі) ішектің ұзындығының үштен жартысынан дюймге дейін, негізінен Теодор Бильхарз және Гризингер Египетте (1854).[18]
Симптомдар жүрек айнуы, іштің ауыруы және мезгіл-мезгіл диарея сияқты анкилостомияны тамақтандыру арқылы ішектегі қабынумен және ұзаққа созылған аурудағы прогрессивті анемиямен байланысты болуы мүмкін: қыңыр тәбет, пика (немесе кірді жеу), іш қатудан кейін диарея, жүрек қағуы, тамыр соғысы, терінің салқындауы, шырышты қабаттардың бозаруы, тез шаршағыштық және әлсіздік, ентігу және өліммен аяқталатын жағдайларда, дизентерия, қан кетулер және ісіну.[18] Құрттар сорады қан және зақымдану шырышты қабық. Алайда, нәжісте қан жоғалту көрінбейді.
Ерте инфекция кезіндегі қан анализі көбінесе эозинофилдердің көбеюін көрсетеді, бұл лейкоциттердің түрі, ол тіндердегі құрт инфекцияларымен ынталандырылады (эозинофилдердің көп мөлшері жергілікті қабыну реакциясында да болады). Қандағы гемоглобин деңгейінің төмендеуі анемиямен ұзақ инфекция кезінде байқалады.
Көптеген ішектерден айырмашылығы гельминтоздар, егер балаларда ең ауыр паразиттік жүктемелер пайда болса, ересек еркектер арасында анкилостомиттің таралуы мен қарқындылығы жоғары болуы мүмкін. Мұның түсіндірмесі, анкилостомиль инфекциясы кәсіби сипатта болады, сондықтан әріптестер және басқа жақын топтар өздерінің жұмыс ортасын ластау арқылы инфекцияның кең таралуын сақтайды. Алайда, эндемиялық аймақтардың көпшілігінде ересек әйелдер анемияға қатты әсер етеді, негізінен олардың темірге деген физиологиялық қажеттіліктері едәуір жоғары (етеккір, жүктіліктің қайталануы). Мұның қызықты нәтижесі Анцилостома он екі елі ішек инфекция - инфекцияның транскрактикалық таралуы: бұл түрдің тері-инвазивті дернәсілдері бірден өкпеден өтіп, ішекке өтіп кетпейді, бірақ бұлшықет талшықтарының ішінде ұйықтап қалу үшін дененің айналасына қан айналымы арқылы таралады. Жүкті әйелде босанғаннан кейін осы дернәсілдердің кейбіреулері немесе барлығының қан айналымына қайта енуі (кенеттен гормоналды өзгерістер болуы мүмкін), содан кейін сүт бездеріне өтуі, жаңа туған нәресте инфекциялық личинкалардың көп мөлшерін алуы үшін ынталандырылады анасының сүті арқылы. Бұл Қытайда, Үндістанда және Австралияның солтүстігінде сияқты бір айлық жастағы балаларда өте ауыр, тіпті өліммен аяқталатын анкилостомикамен ауырудың түсініксіз жағдайларын ескереді. Анцилостома канинумы иттердегі инфекциялар, онда жаңа туылған щеналар ішек-қарыннан қан кетуден өліп қалуы мүмкін, бұл көптеген анкилостомиялармен қоректенеді. Бұл сонымен бірге адам мен ит иттерінің паразиттері арасындағы тығыз эволюциялық байланысты көрсетеді, олардың ата-бабасы адамдар мен иттер алғаш тығыз өмір сүре бастаған кезден басталуы мүмкін. тері немесе олар теріге енгеннен кейін ластанған тамақ пен су арқылы жұтылғанда.
Диагноз

Диагноз нәжісті микроскопиялық зерттеу кезінде тән құрт жұмыртқаларын табуға байланысты, дегенмен бұл ерте инфекция кезінде мүмкін емес. Көптеген иттердің инфекциясының алғашқы белгілеріне аяқ-қолдың ақсауы және анальды қышу жатады. Жұмыртқалары сопақша немесе эллипс тәрізді, өлшемдері 60-40 мкм, түссіз, емес өт боялған және жіңішке мөлдір гиалин қабық қабығы. Ішектегі құрт шығарғанда жұмыртқа құрамында сегменттелмеген болады ұрық жұмыртқасы. Оның ішектен өтуі кезінде жұмыртқа жасушасы дамиды, сөйтіп нәжісте өткен жұмыртқалардың сегменттелген жұмыртқасы болады, әдетте 4-тен 8-ге дейін бластомерлер.Екеуінің жұмыртқасы сияқты Анцилостома және Некатор (және басқа анкилостомидтердің көптеген түрлерін) ажырату мүмкін емес, тұқымды анықтау үшін оларды зертханада өсіру керек, олар личинкалардың шығуына мүмкіндік береді. Егер фекальды үлгіні тропикалық жағдайда бір тәулікке немесе одан да көп уақытқа қалдырса, дернәсілдер шыққан болады, сондықтан жұмыртқалар енді көрінбеуі мүмкін. Мұндай жағдайда анкилостоменттерді ажырата білу керек Стронгилоидтар дернәсілдер, өйткені соңғысымен инфекция ауыр зардаптарға әкеледі және әртүрлі басқаруды қажет етеді. Екі анкилостомиданың личинкаларын микроскопиялық жолмен де ажыратуға болады, дегенмен бұл әдеттегідей жасалмас еді, бірақ әдетте зерттеу мақсатында. Ересек құрттар сирек кездеседі (эндоскопия, хирургия немесе аутопсияны қоспағанда), бірақ табылған жағдайда, түрді анықтауға мүмкіндік береді. Жіктеуді қарынша қуысының ұзындығына, ауыз саңылауы мен өңештің арасына қарай жүргізуге болады: анкилострабт рабдитоформ дернәсілдерінің ұзын буккал қуысы бар Стронгилоидтар рабдитоформ дернәсілдерінің қысқа қуыс қуысы болады.[11]
Жақында жүргізілген зерттеулер инфекцияны диагностикалау, анкилостоменттің нақты идентификациясы және анкилостомия популяцияларындағы генетикалық өзгергіштікті талдау үшін ДНҚ-ға негізделген құралдарды жасауға бағытталған.[19] Анкилосторманың жұмыртқаларын көбінесе басқа паразиттік жұмыртқалардан айырмашылығы бар болғандықтан, ПТР анализ құрты нәжісте диагноз қоюдың молекулалық әдісі бола алады.[19][20]
Алдын алу
Инфекциялық дернәсілдер ылғалды, әсіресе құмды және сазды топырақта дамиды және тіршілік етеді. Олар сазда немесе сазда тіршілік ете алмайды. Сақтық шарасының негізгі сызықтары - жақсылыққа нұсқау гигиена мінез-құлық:
- Істемеймін ашық жерде дәрет шығару, керісінше дәретханалар.
- Өңделмеген заттарды қолданбаңыз адамның шығаруы немесе шикі ағынды сулар сияқты тыңайтқыш ауыл шаруашылығында.
- Жұқтырған белгілі жерлерде жалаң аяқ жүрмеңіз.
- Үй жануарларының иттері мен мысықтарын құрт. Аналық құрттар мен иттердің мысықтары сирек кездеседі. Анцилостома канинумы, кәдімгі ит анкилостомиясы, кейде ересек адамға айналады эозинофильді энтерит адамдарда, бірақ олардың инвазиялық личинкалары қышыма бөртпені тудыруы мүмкін тері личинкалары.
Моксидектин Америка Құрама Штаттарында (имидаклоприд + моксидектин) иттер мен мысықтарға арналған жергілікті ерітінді. Ол моксидектинді жұмыр құрттарды, анкилостомидаларды бақылау және алдын алу үшін пайдаланады, жүрек құрттары, және қарақұрт.

Балалар
Бұл денсаулық сақтау мәселелерінің көпшілігі анкилостомен ауырған балаларға бағытталған. Балаларға мұндай көңіл бөлу көбінесе анкилостомиданың инфекциясы мен оқудың нашарлауы, сабаққа келмеудің артуы және болашақ экономикалық өнімділіктің төмендеуі арасындағы күшті байланыстарды көрсеткен көптеген дәлелдемелермен байланысты.[12] 2001 жылы 54-ші Дүниежүзілік денсаулық сақтау ассамблеясы мүше мемлекеттерден 2010 жылға дейін барлық қауіп-қатер тобындағы мектеп оқушыларының кем дегенде 75% құртсыздандырудың минималды мақсатына жетуді талап ететін қарар қабылдады.[21] Дүниежүзілік денсаулық сақтау ұйымының 2008 жылғы басылымы қауіп тобындағы мектеп оқушыларын емдеу бойынша осы әрекеттер туралы хабарлады. Кейбір қызықты статистика келесідей болды: 1) 130% эндемикалық елдердің тек 9-ы 75% мақсатты мақсатқа жете алды; және 2) мектеп жасындағы 77 миллионнан аз балаларға (жалпы 878 миллион қауіптілікке) қол жеткізілді, бұл қауіпті топтағы балалардың тек 8,78% -ы анкилостомент инфекциясынан емделіп жатқанын білдіреді.[22]
Мектептегі жаппай дегельминтизация
Мектеп негізінде жаппай дегельминтизация бағдарламалар балалардағы анкилостомиланы жұқтыру мәселесін шешудің ең танымал стратегиясы болды. Мектептегі бағдарламалар өте тиімді, өйткені мектептер қазірдің өзінде қол жетімді, ауқымды және тұрақты инфрақұрылымға ие, білікті жұмыс күші бар, олар қоғамдастықпен тығыз байланыста.[21] Жергілікті денсаулық сақтау жүйесінің аз дайындығымен мұғалімдер жылына бір балаға 0,50 АҚШ долларынан төмен тұратын дәрілерді оңай басқара алады.[23]
Жақында көптеген адамдар мектептегі бағдарламалар ең тиімді тәсіл бола ма деген сұрақ қоя бастады. Мектептегі бағдарламаларға қатысты маңызды мәселе олардың мектепке бармайтын балаларға жиі жете алмауы, осылайша қауіп тобындағы балалардың көп мөлшерін елемеуі болып табылады. Массаның 2008 жылғы зерттеуі т.б. мектеп бағдарламаларына қатысты пікірталасты жалғастырды. Олар Танзанияның Танга аймағындағы мектеп емдеуіне қарсы қауымдастыққа бағытталған емдеудің әсерін зерттеді. Негізгі қорытынды, анкилостоменттің инфекциясының орташа қарқындылығы ауылда емдеу тәсілін қолданатын ауылдарда мектептікке қарағанда едәуір төмен болды. Осы нақты зерттеуде қолданылған қоғамға бағытталған емдеу үлгісі ауыл тұрғындарына антигельминтикалық препараттарды тағайындау үшін ауылдастарына өздерінің есірткі таратушыларын таңдау арқылы баланың емделуін бақылауға алуға мүмкіндік берді. Сонымен қатар, ауыл тұрғындары есірткіні барлық балаларға тарату әдістерін ұйымдастырды және енгізді.[24] Осы жаңа модельге байланысты оң нәтижелер дегельминтизация науқанына қоғамдастықтың кең ауқымды қатысуын қажет етеді.
Қоғамдық денсаулық сақтау білімі
Көптеген дегельминтизация бағдарламалары өздерінің күш-жігерін қоғамдық денсаулық сақтау білімімен біріктіреді. Денсаулық сақтау саласындағы білім беру бағдарламалары көбінесе маңызды профилактикалық әдістерге баса назар аударады, мысалы: тамақтанар алдында қолыңызды жуу, және адам нәжісімен ластанған судан / жерлерден аулақ болу. Бұл бағдарламалар сонымен қатар аяқ киімді кию керек деп баса назар аударуы мүмкін, бірақ олар денсаулыққа қауіп төндіреді және тиімді болмауы мүмкін.[25] Әлемдегі қалалар мен ауылдардағы аяқ киім кию мәдени наным-сенімдермен және сол қоғамдағы білім деңгейлерімен анықталады. Аяқ киімді кию анкилостомит инфекциясының қоршаған топырақтан нәзік тері аймақтарына енуіне жол бермейді; сияқты саусақтардың арасындағы аймақтар.[26]
Санитарлық тазалық
1943-1947 жылдардағы Миссисипи мен Флоридадағы анкилостомания науқандары сияқты тарихи мысалдар көрсеткендей, анкилостомиданы жұқтырудың негізгі себебі нашар санитарлық-гигиеналық жағдай, оны салу және сақтау арқылы шешуге болады. дәретханалар. Бірақ бұл қарапайым міндеттер болып көрінгенімен, денсаулық сақтау саласындағы маңызды проблемаларды көтереді. Вирус жұқтырған халықтың көпшілігі санитарлық жағдайы өте нашар кедейлікке ұшыраған аудандардан. Осылайша, ең алдымен, қауіп тобындағы балалар қол жетімді емес таза су дейін қолдарын жуу және тиісті санитарлық инфрақұрылымы жоқ ортада өмір сүру. Денсаулық сақтау саласындағы білім алдын-алу шараларын ресурстармен шектелген жағдайда мүмкін болатын және орнықты тәсілдермен шешуі керек.
Кешенді тәсілдер
Денсаулық сақтау саласындағы көптеген іс-шараларды бағалау, әдетте, кедейлікке байланысты әрбір жеке компоненттің жақсаруы (мысалы, санитарлық тазалық, медициналық білім және тамақтанудың негізгі жағдайы) көбінесе жұғуға аз әсер ететіндігін көрсетті. Мысалы, бір зерттеу көрсеткендей, дәретхананы ресурстармен шектелген қоғамдастыққа енгізу анкилостомильді инфекцияның таралуын тек төрт пайызға төмендеткен.[27] Алайда, Бразилияның Сальвадор қаласында жүргізілген тағы бір зерттеудің нәтижесі жақсарғаны анықталды дренаж және канализация болды айтарлықтай әсер ету анкилостомильді инфекцияның таралуы туралы, бірақ анкилостомильді инфекцияның қарқындылығына әсер етпейді.[28] Бұл анологиялық құрттарды таратуға тек экологиялық бақылаудың шектеулі, бірақ толық емес әсер ететіндігін айғақтайтын сияқты. Сондықтан білім беру, санитарлық тазалау және емдеуді қоса алғанда көптеген профилактикалық әдістерді біріктіретін интеграцияланған бағдарламалардың тиімділігі мен тұрақтылығын түсіну үшін көбірек зерттеулер жүргізу қажет.
Емдеу
Антельминтикалық препараттар
Анкилостомильді емдеудің ең көп таралған әдісі бензимидазолдар, нақты албендазол және мебендазол. BZA ересек құрттарды нематодтың β- байланыстырып өлтіредітубулин және кейіннен тежеу микротүтікше паразит ішіндегі полимеризация.[14] Белгілі бір жағдайларда, левамизол және пирантел памоат қолданылуы мүмкін.[12] 2008 жылғы шолуда анкилостоминфекцияға қарсы бір реттік емнің тиімділігі келесідей болды: альбендазол үшін 72%, мебендазол үшін 15% және пирантел памоат үшін 31%.[29] Бұл альбендазолдың анбеномилоз инфекциясына қарағанда мебендазолға қарағанда әлдеқайда тиімді екендігі туралы алдыңғы пікірлерін дәлелдейді. Сондай-ақ, Дүниежүзілік денсаулық сақтау ұйымы бірінші триместрден кейін жүкті әйелдерде антигельминтикалық емдеуді ұсынатындығын ескеру қажет.[14] Сондай-ақ, егер науқас анемиямен ауыратын болса, кеңес беріледі темір сульфаты (200 мг) антигельминтикалық еммен бір мезгілде күніне үш рет енгізіледі; бұл 3 айға созылуы мүмкін гемоглобин көрсеткіштері қалыпқа келгенге дейін жалғасуы керек.[11]
Анкилостомильді инфекцияны жергілікті емдеуге болады криотерапия анкилостомид теріде болған кезде.[30]
Албендазол ішек сатысында да, сатысында да паразит тері астына қозғалады.[30]
Анемия жағдайында, темір қоспа жеңілдету симптомдарын тудыруы мүмкін темір тапшылығы анемиясы. Алайда, эритроциттердің деңгейі қалпына келтірілгенде, басқа да қажетті заттардың тапшылығы фолий қышқылы немесе В12 дәрумені дамуы мүмкін, сондықтан оларды толықтыруға болады.
Реинфекция және дәріге төзімділік
Анкилостоминді емдеуге байланысты басқа маңызды мәселелер реинфекция және дәріге төзімділік болып табылады. Емдеуден кейін реинфекция өте жоғары болуы мүмкін екендігі көрсетілген. Кейбір зерттеулер тіпті анкилостоминамен инфекцияның алдын-ала емделуінің 80% -ы 30–36 ай ішінде емделген қауымдастықта байқалатынын көрсетеді.[14] Реинфекция орын алуы мүмкін болса да, үнемі емдеу жүргізіп отыру ұсынылады, себебі бұл созылмалы нәтижелердің пайда болуын азайтады. Сондай-ақ, есірткіге төзімділік мәселесіне қатысты алаңдаушылық күшейеді. Есірткіге төзімділік мал нематодтары үшін қолданылатын алдыңғы қатардағы антигельминтиктерде пайда болды. Әдетте адамның нематодтары көбею уақытының ұзақтығына, емделудің аз болуына және мақсатты емделуге байланысты төзімділікті төмендетеді. Дүниежүзілік қауымдастық қазіргі антигельминтикалық препараттардың тиімділігін сақтауға абай болу керек, өйткені жаңа антигельминтикалық препараттар дамудың соңғы сатысында жоқ.[14]
Эпидемиология
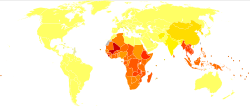
576 - 740 миллион адам анкилостомен ауырады деп есептеледі.[31][14] Осы жұқтырған адамдардың 80 миллионға жуығы қатты зардап шегеді.[19] Анкилостомильді инфекцияның негізгі себебі болып табылады N. americanus ол Америкада, Сахараның оңтүстігінде және Азияда кездеседі.[12] A. duodenale неғұрлым шашыранды фокустық ортада, атап айтқанда Еуропа мен Жерорта теңізінде кездеседі. Вирус жұқтырған адамдардың көпшілігі Сахараның оңтүстігінде және Шығыс Азияда / Тынық мұхит аралдарында шоғырланған, олардың әр аймағында тиісінше 198 миллион және 149 миллион жұқтырған адамдар бар. Зардап шеккен басқа аймақтарға мыналар жатады: Оңтүстік Азия (50 млн), Латын Америкасы және Кариб теңізі (50 млн), Оңтүстік Азия (59 млн), Таяу Шығыс / Солтүстік Африка (10 млн).[14] Ауру жұқтырған адамдардың көпшілігі кедейлік жағдайында, санитарлық жағдайы нашар жерлерде тұрады. Анкилостомиль инфекциясы әлемдегі ең кедей адамдар арасында шоғырланған, олар күніне 2 доллардан аспайды.[12]
Анкилостомиданың инфекциясы өлімге тікелей әкеп соқтырмаса да, оның аурушаңдыққа әсері жедел назар аударуды қажет етеді. Қарастыру кезінде мүгедектікке байланысты өмір сүру жылдары (DALYs), ескерілмеген тропикалық аурулар, оның ішінде анкилостоминт инфекциясы, диарея аурулары арасында, жүректің ишемиялық ауруы, безгек, және туберкулез дамушы әлемнің маңызды денсаулық сақтау проблемаларының бірі ретінде.
Болжам бойынша 22,1 млн DALYs анкилостомиль инфекциясы салдарынан жоғалған. Жақында анкилостоминфекциямен байланысты денсаулыққа қатысты мәселелерді шешуге қызығушылық артып келеді. Мысалы, Билл және Мелинда Гейтстің қоры жақында аналық құрт инфекциясын қоса, немқұрайлы тропикалық аурулармен күресу үшін 34 миллион АҚШ долларын аударды.[32] АҚШ-тың бұрынғы президенті Клинтон да Клинтонның жаһандық бастамасының (CGI) 2008 жылдық жиналысында 10 миллион баланы құрттан арылту туралы мега-міндеттеме жариялады.[33]
Анкилостомирустық инфекцияның таралуына қатысты көптеген сандар болжам болып табылады, өйткені қазіргі кезде таралуы мен жаһандық таралуын анықтайтын халықаралық қадағалау тетігі жоқ.[12] Кейбір таралу деңгейлері әлемнің эндемикалық аймақтарындағы зерттеу деректері арқылы өлшенді. Төменде анкилостомидалы эндемиялық аймақтардағы таралу деңгейлері туралы соңғы бірнеше мәліметтер келтірілген.
Дарджилинг, Хугли ауданы, Батыс Бенгалия, Үндістан (Пал т.б. 2007)[34]
- Инфекция деңгейі 43% құрайды N. americanus кейбіреулерімен болса да A. duodenale инфекция
- Анкилостоминаның инфекциясы да, анемия деңгейі де жеңіл дәрежеде
Сюлонгкан Ауыл, Хайнань провинциясы, Қытай (Ганди т.б. 2001)[35]
- 60% инфекция деңгейі N. americanus
- Белгіленген маңызды тенденциялардың таралуы қартайған сайын ұлғаюы болды (плато шамамен 41 жаста) және әйелдердің таралуы ерлерге қарағанда жоғары болды
Hòa Bình, Вьетнамның солтүстік-батысы (Верле.) т.б. 2003)[36]
- Жалпы тексерілген 526 үй шаруашылығының 52% -ы жұқтырған
- Түрлерді анықтай алмады, бірақ Солтүстік Вьетнамдағы алдыңғы зерттеулер туралы хабарлады N. americanus анкилостминт дернәсілдерінің 95% -дан астамында
Минас-Жерайс, Бразилия (Флеминг т.б. 2006)[37]
- Инфекция деңгейі 63% құрайды N. americanus
КваЗулу-Наталь, Оңтүстік Африка (Мабасо т.б. 2004)[38]
- Ішкі аудандардың таралу деңгейі 9% құрады N. americanus
- Жағалаудағы жазық аудандардың таралу деңгейі 63% құрады N. americanus
Лаундес округі, Алабама, АҚШ [39][40]
- Инфекция деңгейі 35% құрайды N. americanus
Анкилостомилиттің таралуын дәлірек бейнелеуге көмектесетін технологиялық әзірлемелер болды. Кейбір зерттеушілер гельминт экологиясы мен эпидемиологиясын зерттеу үшін географиялық ақпараттық жүйелерді (ГАЖ) және қашықтықтан зондтауды (RS) қолдана бастады. Брукер т.б. бұл технологияны Африканың Сахараның оңтүстігіндегі гельминттердің тарату карталарын жасау үшін қолданды. Экологиялық спутниктік деректерді мектепте жүргізілген сауалнамалардың таралу деректерімен байланыстыра отырып, олар кең таралудың карталарын құра алды. Зерттеу гельминттердің кең спектріне бағытталды, бірақ анкилостомидалар туралы қызықты қорытындылар табылды. Басқа гельминттермен салыстырғанда, анкилостомия әлдеқайда ыстық жағдайда тіршілік ете алады және термиялық диапазонның жоғарғы шегінде өте кең таралған.[41]
Жақсартылған молекулалық диагностикалық құралдар - бұл таралудың статистикасын жақсартуға көмектесетін тағы бір технологиялық жетістік. Жақында жүргізілген зерттеулер инфекцияны диагностикалауға, анкилостоматты ерекше идентификациялауға және анкилостомия популяцияларындағы генетикалық өзгергіштікті талдауға болатын ДНҚ-ға негізделген құралды жасауға бағытталған. Бұл тағы да анкилостоминфекцияға қарсы қоғамдық денсаулық сақтау шараларының негізгі құралы бола алады. Диагностикалық құралдарға қатысты зерттеулердің көпшілігі қазір анкилостомилит инфекциясының нақты диагностикасы үшін тез және үнемді талдау жасауға бағытталған. Көпшілік оның дамуына алдағы бес жыл ішінде қол жеткізуге болады деп үміттенеді.[қашан? ][19]
Тарих
Ашу
Енді анкилостоментке тән белгілер пайда болады папирус ежелгі қағаздар Египет (шамамен 1500 ж. дейін), анемиямен сипатталатын ауытқушылық ретінде сипатталған. Авиценна, ХІ ғасырдың парсы дәрігері, бірнеше науқастардан құртты тауып, оны олардың ауруымен байланыстырды. Кейінгі кезде бұл жағдай кен өндіру өнеркәсібінде кең таралды Англия, Франция, Германия, Бельгия, Солтүстік Квинсленд, және басқа жерлерде.[18]
Итальяндық дәрігер Анджело Дубини құрттың қазіргі ашушысы болды 1838 ж. кейін аутопсия шаруа әйелінің. Дубини 1843 жылы егжей-тегжейлерін жариялады және түрді анықтады A. duodenale. Египеттің медициналық жүйесінде 1852 жылы неміс дәрігері жұмыс істеді Теодор Бильхарз, әріптесінің жұмысына сүйене отырып Вильгельм Гризингер, бұл құрттарды аутопсия кезінде тауып, оларды жергілікті эндемиялық құбылыстармен байланыстыруда біршама алға жылжыды хлороз, мүмкін бұл атау болар еді темір тапшылығы анемиясы бүгін.
25 жылдан кейін үлкен жетістік а диарея және анемия арасында болған эпидемия Итальян бойынша жұмыс істейтін жұмысшылар Готтард рельсті туннелі.[18] 1880 жылғы мақалада дәрігерлер Камилло Боззоло, Эдоардо Перронцито, және Луиджи Пальяни анкилостомид жұмысшылардың 15 шақырымдық туннельде нәжіс шығаруы керек екендігімен және көптеген адамдар тозған аяқ киімдермен байланысты деген дұрыс болжам жасады.[42] 1897 жылы терінің инфекцияның негізгі жолы екендігі анықталды биологиялық өмірлік цикл анкилостомиданың нақтыланды.
Жою бағдарламалары
1899 жылы американдық зоолог Чарльз Уарделл прогрессивті деп анықталды қауіпті анемия Құрама Штаттардың оңтүстігінде анкилостомен қоздырғыш ретінде көрінеді A. duodenale. 1900 жылдардағы тестілеу мектеп жасындағы балаларда өте ауыр инвазияларды анықтады. Жылы Пуэрто-Рико, АҚШ армиясының дәрігері, доктор Бэйли К.Эшфорд паразиттерді емдеу науқанын ұйымдастырды және жүргізді, бұл шамамен 300,000 адамды (Пуэрто-Рико тұрғындарының үштен бірі) сауықтырды және осы анемиядан болатын өлім-жітімді жылдар ішінде 90 пайызға төмендетті. 1903–04.

1909 жылы 26 қазанда анкилостомид ауруын жою бойынша Рокфеллердің санитарлық комиссиясы 1 миллион АҚШ доллары көлеміндегі сыйлықтың нәтижесінде ұйымдастырылды. Джон Д. Рокфеллер Бесжылдық бағдарлама оңтүстік штаттардағы халыққа білім беру, дәрі-дәрмек, дала жұмыстары мен заманауи үкіметтік денсаулық сақтау департаменттерін енгізіп, Америка Құрама Штаттарының денсаулық сақтауына үлкен үлес болды.[43]Анкилостома көрмесі 1910 жылы Миссисипи штатындағы мемлекеттік жәрмеңкенің көрнекті бөлігі болды.
Комиссия мектеп жасындағы балалардың орта есеппен 40% -ы анкилостомен ауырғанын анықтады. Жою бағдарламасына дейін анкилостомикамен инфекция деңгейі жоғары аудандарда мектепке бару, сабаққа қатысу және араласудан кейін сауаттылық жоғарылаған. Эконометрикалық зерттеулер көрсеткендей, бұл әсерді әр түрлі баламалы факторлармен, соның ішінде аймақтар бойынша дифференциалды тенденциялармен, өсімдік бағасының өзгеруімен, білім беру мен денсаулық сақтау саласындағы кейбір саясаттың өзгеруімен және безгекті жою әсерімен түсіндіруге болмайды.[44] Ересектер үшін инфекция деңгейінің едәуір төмен (алдын-ала) болуына байланысты интервенциядан азырақ пайда көруі керек болған кезде маңызды нәтижелер табылған жоқ. Бағдарлама анкилостомияны дерлік жойды және кейіннен жаңа қаржыландырумен дами түсетін еді Рокфеллер қоры Халықаралық денсаулық сақтау бөлімі.[45]
Мексикадағы РФ-ның анкилостомонт науқаны ғылым мен саясаттың денсаулық сақтау саясатын құрудағы рөлін көрсетті. Оған мемлекеттік қызметкерлер, денсаулық сақтау саласының қызметкерлері, денсаулық сақтау қызметкерлері, Рокфеллер шенеуніктері және қоғамдастық жиналды. Бұл науқан Мексикада анкилостомидаларды жою мақсатында басталды. Науқан ұзақ мерзімді емдеуге бағытталмағанымен, Мексика мен Рокфеллер қорының арасындағы қарым-қатынастың шарттарын белгіледі. Осы науқанның негізіндегі ғылыми білім қоғамдық денсаулық сақтау саясатын қалыптастыруға, халықтың денсаулығын жақсартуға және АҚШ пен Мексика арасында берік қарым-қатынас орнатуға көмектесті.[46]
20-шы жылдары анкилостомиданы жою Кариб теңізі мен Латын Америкасына жетті, сол жерде адамдар арасында өлім-жітім көп болды. Батыс Үндістан соңына қарай, сондай-ақ жіберілген сипаттамалар арқылы Бразилия және басқа да әр түрлі тропикалық және субтропиктік аймақтар.[18]
Емдеу
Ерте емдеу емдеуге негізделген ащы тұз қорғаныш шырышты азайту үшін, содан кейін тимол құрттарды өлтіру.[47] Кейінірек тетрахлорэтилен жетекші әдіс болды. ХХ ғасырдың ортасында жаңа органикалық дәрілік қосылыстар пайда болғанға дейін ғана болды.[48]
Зерттеу
Жүктілік кезіндегі анемия
Дамушы елдердегі барлық жүкті әйелдердің үштен бір бөлігі анкилостомен ауырады, дамушы елдердегі барлық жүкті әйелдердің 56% анемиядан зардап шегеді, ана өлімінің 20% анемиямен тікелей немесе жанама байланысты. Осындай сандар жүктілік кезінде анкилостомиямен байланысты анемия тақырыбына қызығушылықты арттырды.[49] With the understanding that chronic hookworm infection can often lead to anemia, many people are now questioning if the treatment of hookworm could effect change in severe anemia rates and thus also on maternal and child health as well. Most evidence suggests that the contribution of hookworm to maternal anemia merits that all women of child-bearing age living in endemic areas be subject to periodic anthelmintic treatment. The World Health Organization even recommends that infected pregnant women be treated after their first trimester.[14] Regardless of these suggestions, only Madagascar, Nepal and Sri Lanka have added deworming to their antenatal care programs.[50]
This lack of deworming of pregnant women is explained by the fact that most individuals still fear that anthelmintic treatment will result in adverse birth outcomes. But a 2006 study by Gyorkos et al. found that when comparing a group of pregnant women treated with mebendazole with a control placebo group, both illustrated rather similar rates in adverse birth outcomes. The treated group demonstrated 5.6% adverse birth outcomes, while the control group had 6.25% adverse birth outcomes.[49] Furthermore, Larocque et al. illustrated that treatment for hookworm infection actually led to positive health results in the infant. This study concluded that treatment with mebendazole plus iron supplements during antenatal care significantly reduced the proportion of very low birth weight infants when compared to a placebo control group.[51] Studies so far have validated recommendations to treat infected pregnant women for hookworm infection during pregnancy.
A review of effects of antihelminthics (anti-worm drugs) given in pregnancy found that there was not enough evidence to support treating pregnant women in their second or third trimesters.[52] The women who were treated in the second trimester and the women who had no treatment showed no difference in numbers of maternal anemia, low birth weight, preterm birth or deaths of babies.[52]
The intensity of hookworm infection as well as the species of hookworm have yet to be studied as they relate to hookworm-related anemia during pregnancy. Additionally, more research must be done in different regions of the world to see if trends noted in completed studies persist.
Malaria co-infection
Co-infection with hookworm and Plasmodium falciparum is common in Africa.[53] Although exact numbers are unknown, preliminary analyses estimate that as many as a quarter of African schoolchildren (17.8–32.1 million children aged 5–14 years) may be coincidentally at-risk of both P. falciparum and hookworm.[54] While original hypotheses stated that co-infection with multiple parasites would impair the host's immune response to a single parasite and increase susceptibility to clinical disease, studies have yielded contrasting results. For example, one study in Senegal showed that the risk of clinical malaria infection was increased in helminth-infected children in comparison to helminth-free children while other studies have failed to reproduce such results,[55] and even among laboratory mouse experiments the effect of helminths on malaria is variable.[56]
Some hypotheses and studies suggest that helminth infections may protect against cerebral malaria due to the possible modulation of pro-inflammatory and anti-inflammatory cytokines responses.[57] Furthermore, the mechanisms underlying this supposed increased susceptibility to disease are unknown. For example, helminth infections cause potent and highly polarized immune response characterized by increased Т-көмекші ұяшық type 2 (Tсағ2) цитокин және Иммуноглобулин Е (IgE) production.[58] However, the effect of such responses on the human immune response is unknown. Additionally, both malaria and helminth infection can cause anemia, but the effect of co-infection and possible enhancement of anemia is poorly understood.[48]
Hygiene hypothesis and hookworm as therapy
The гигиеналық гипотеза states that infants and children who lack exposure to infectious agents are more susceptible to allergic diseases via modulation of immune system development. The theory was first proposed by David P. Strachan who noted that поллиноз және экзема were less common in children who belonged to large families.[59] Since then, studies have noted the effect of gastrointestinal worms on the development of allergies in the developing world. For example, a study in Gambia found that eradication of worms in some villages led to increased skin reactions to allergies among children.[60]
Вакциналар
While annual or semi-annual mass antihelminthic administration is a critical aspect of any public health intervention, many have begun to realize how unsustainable it is due to aspects such as poverty, high rates of re-infection, and diminished efficacy of drugs with repeated use. Current research, therefore, has focused on the development of a vaccine that could be integrated into existing control programs. The goal of vaccine development is not necessarily to create a vaccine with sterilizing immunity or complete protection against immunity. A vaccine that reduces the likelihood of vaccinated individuals developing severe infections and thus reduced blood and nutrient levels could still have a significant impact on the high burden of disease throughout the world.
Current research focuses on targeting two stages in the development of the worm: the larval stage and the adult stage. Research on larval antigens has focused on proteins that are members of the патогенезге байланысты ақуыз суперотбасы, Анцилостома Secreted Proteins.[61] Although they were first described in Anyclostoma, these proteins have also been successfully isolated from the secreted product of N. americanus. N. americanus ASP-2 (Na-ASP-2) is currently the leading larval-stage hookworm vaccine candidate. A randomized, double-blind, placebo-controlled study has already been performed; 36 healthy adults without a history of hookworm infection were given three intramuscular injections of three different concentrations of Na-ASP-2 and observed for six months after the final vaccination.[62] The vaccine induced significant anti-Na-ASP-2 IgG and cellular immune responses. In addition, it was safe and produced no debilitating side effects. The vaccine is now in a phase one trial; healthy adult volunteers with documented evidence of previous infection in Brazil are being given the same dose concentration on the same schedule used in the initial study.[61] If this study is successful, the next step would be to conduct a phase two trial to assess the rate and intensity of hookworm infection among vaccinated persons. Because the Na-ASP-2 vaccine only targets the larval stage, it is critical that all subjects enrolled in the study be treated with antihelminthic drugs to eliminate adult worms prior to vaccination.
Adult hookworm antigens have also been identified as potential candidates for vaccines. When adult worms attach to the intestinal mucosa of the human host, erythrocytes are ruptured in the worm's digestive tract which causes the release of free hemoglobin which is subsequently degraded by a proteolytic cascade. Several of these proteins that are responsible for this proteolytic cascade are also essential for the worm's nutrition and survival.[63] Therefore, a vaccine that could induce antibodies for these antigens could interfere with the hookworm's digestive pathway and impair the worm's survival. Three proteins have been identified: the aspartic protease-hemoglobinase APR-1, the cysteine protease-hemoglobinase CP-2, and a glutathione S-transferase.[64][65][66] Vaccination with APR-1 and CP-2 led to reduced host blood loss and fecal egg counts in dogs.[64][65] With APR-1, vaccination even led to reduced worm burden.[64] Research is currently stymied at the development of at least one of these antigens as a recombinant protein for testing in clinical trials.
Терминология
The term "hookworm" is sometimes used to refer to hookworm infection.[12] A hookworm is a type of parasitic worm (гельминт ).
Сондай-ақ қараңыз
Пайдаланылған әдебиеттер
- ^ а б c г. e f ж сағ мен j к л м n o б q р с "CDC - Hookworm - General Information - Frequently Asked Questions (FAQs)". www.cdc.gov. 16 желтоқсан 2014 ж. Мұрағатталды түпнұсқадан 2017 жылғы 22 сәуірде. Алынған 22 сәуір 2017.
- ^ а б "CDC - Hookworm - Disease". www.cdc.gov. 10 қаңтар 2013 ж. Мұрағатталды түпнұсқадан 2017 жылғы 23 сәуірде. Алынған 22 сәуір 2017.
- ^ а б c "CDC - Hookworm - Treatment". www.cdc.gov. 10 қаңтар 2013 ж. Мұрағатталды түпнұсқадан 2017 жылғы 23 сәуірде. Алынған 22 сәуір 2017.
- ^ а б GBD 2015 аурулары мен жарақаттарының таралуы және таралуы, серіктестер. (8 қазан 2016). «1990–2015 жж. 310 ауру мен жарақаттанудың ғаламдық, аймақтық және ұлттық аурушаңдығы, таралуы және мүгедектікпен өмір сүрген жылдары: 2015 жылға арналған аурулардың ғаламдық ауыртпалығын жүйелі талдау». Лансет. 388 (10053): 1545–1602. дои:10.1016 / S0140-6736 (16) 31678-6. PMC 5055577. PMID 27733282.
- ^ Алдын алу, CDC - Ауруларды бақылау орталықтары және. "CDC - Hookworm - Biology". www.cdc.gov. Мұрағатталды түпнұсқадан 2017 жылғы 21 маусымда. Алынған 21 маусым 2017.
- ^ GBD 2015 өлімі және өлімнің себептері, әріптестер. (8 қазан 2016). «Ғаламдық, аймақтық және ұлттық өмір сүру ұзақтығы, барлық себептерден болатын өлім және өлім-жітімнің 249 себебі бойынша өлім, 1980–2015 жж.: 2015 жылға арналған аурулардың ғаламдық ауыртпалығын жүйелі талдау». Лансет. 388 (10053): 1459–1544. дои:10.1016 / s0140-6736 (16) 31012-1. PMC 5388903. PMID 27733281.
- ^ «Елемейтін тропикалық аурулар». cdc.gov. 2011 жылғы 6 маусым. Мұрағатталды түпнұсқасынан 4 желтоқсан 2014 ж. Алынған 28 қараша 2014.
- ^ Джеймс, Уильям Д .; Бергер, Тимоти Г .; т.б. (2006). Эндрюс терісінің аурулары: клиникалық дерматология. Сондерс Эльзевье. бет.435. ISBN 978-0-7216-2921-6.
- ^ "Hookworms." The Center for Food Security and Public Health. May 2005. Iowa State University
- ^ "CDC - Zoonotic Hookworm - General Information". www.cdc.gov. 25 сәуір 2019. Алынған 27 желтоқсан 2019.
- ^ а б c г. e f ж Markell, Edward K.; John, David C.; Petri, William H. (2006). Markell and Voge's medical parasitology (9-шы басылым). Сент-Луис, Мо: Эльзеве Сондерс. ISBN 978-0-7216-4793-7.
- ^ а б c г. e f ж сағ мен j Hotez PJ, Bethony J, Bottazzi ME, Brooker S, Buss P (March 2005). «Анкилостомина»: Адамзатқа ұлы инфекция"". PLOS Med. 2 (3): e67. дои:10.1371/journal.pmed.0020067. PMC 1069663. PMID 15783256.
- ^ "CDC Factsheet: Hookworm" Мұрағатталды 2010-09-04 Wayback Machine, қол жеткізілді 29 қыркүйек 2008 ж
- ^ а б c г. e f ж сағ мен Bethony J, Brooker S, Albonico M, Geiger SM, Loukas A, Diemert D, Hotez PJ (May 2006). «Топырақ арқылы берілетін гельминт инфекциялары: аскаридоз, трихурия және анкилостомия». Лансет. 367 (9521): 1521–32. дои:10.1016 / S0140-6736 (06) 68653-4. PMID 16679166. S2CID 8425278.
- ^ Hawdon JM, Hotez PJ (October 1996). "Hookworm: developmental biology of the infectious process". Curr. Опин. Генет. Дев. 6 (5): 618–23. дои:10.1016/S0959-437X(96)80092-X. PMID 8939719.
- ^ Stoll NR (August 1962). "On endemic hookworm, where do we stand today?". Exp. Паразитол. 12 (4): 241–52. дои:10.1016/0014-4894(62)90072-3. PMID 13917420.
- ^ Hotez PJ, Pritchard DI (1995). «Анкилостомиль инфекциясы». Ғылыми американдық. Том. 272 жоқ. 6. pp. 68–74. дои:10.1038 / Scientificamerican0695-68. PMID 7761817.
- ^ а б c г. e
 Алдыңғы сөйлемдердің біреуі немесе бірнешеуі қазір басылымдағы мәтінді қамтиды қоғамдық домен: Чисхольм, Хью, ред. (1911). «Анкилостомоз ". Britannica энциклопедиясы. 2 (11-ші басылым). Кембридж университетінің баспасы. б. 58.
Алдыңғы сөйлемдердің біреуі немесе бірнешеуі қазір басылымдағы мәтінді қамтиды қоғамдық домен: Чисхольм, Хью, ред. (1911). «Анкилостомоз ". Britannica энциклопедиясы. 2 (11-ші басылым). Кембридж университетінің баспасы. б. 58. - ^ а б c г. Gasser RB, Cantacessi C, Campbell BE (January 2009). "Improved molecular diagnostic tools for human hookworms". Expert Rev. Mol. Диагностика. 9 (1): 17–21. дои:10.1586/14737159.9.1.17. PMID 19099345. S2CID 32970805.
- ^ Yong TS, Lee JH, Sim S, Lee J, Min DY, Chai JY, Eom KS, Sohn WM, Lee SH, Rim HJ (March 2007). "Differential diagnosis of Trichostrongylus and hookworm eggs via PCR using ITS-1 sequence". Korean J. Parasitol. 45 (1): 69–74. дои:10.3347/kjp.2007.45.1.69. PMC 2526333. PMID 17374982.
- ^ а б "School Deworming". Public Health at a Glance. Дүниежүзілік банк. 2003 ж.
- ^ "Soil-transmitted helminthiasis". Жақсы. Эпидемиол. Rec. 83 (27/28): 237–252. 4 шілде 2008 ж.
- ^ "How does deworming work?" Deworm the World. <dewormtheworld.org Мұрағатталды 2009-02-08 Wayback Machine >
- ^ Massa K, Magnussen P, Sheshe A, Ntakamulenga R, Ndawi B, Olsen A (2009). "The effect of the community-directed treatment approach versus the school-based treatment approach on the prevalence and intensity of schistosomiasis and soil-transmitted helminthiasis among schoolchildren in Tanzania". Транс. R. Soc. Троп. Мед. Hyg. 103 (1): 31–37. дои:10.1016/j.trstmh.2008.07.009. PMID 18771789.
- ^ Howell, Daniel (2010). The Barefoot Book: 50 Great Reasons to Kick Off Your Shoes. Hunter House. ISBN 978-0897935548.
- ^ Birn & Solórzano 1999, pp. 1200, 1205
- ^ Huttly SR (1990). "The impact of inadequate sanitary conditions on health in developing countries". World Health Stat. Q. 43 (3): 118–26. PMID 2146815.
- ^ Moraes LR, Cancio JA, Cairncross S (April 2004). "Impact of drainage and sewerage on intestinal nematode infections in poor urban areas in Salvador, Brazil". Транс. R. Soc. Троп. Мед. Hyg. 98 (4): 197–204. дои:10.1016/S0035-9203(03)00043-9. PMID 15049458.
- ^ Keizer J, Utzinger J (сәуір 2008). "Efficacy of current drugs against soil-transmitted helminth infections: systematic review and meta-analysis". Дж. Мед. Доц. 299 (16): 1937–48. дои:10.1001 / jama.299.16.1937 ж. PMID 18430913.
- ^ а б Albanese G, Venturi C, Galbiati G (2001). "Treatment of larva migrans cutanea (creeping eruption): A comparison between albendazole and traditional therapy". Int. Дж. Дерматол. 40 (1): 67–71. дои:10.1046/j.1365-4362.2001.01103.x. PMID 11277961. S2CID 40314184.
- ^ Fenwick A (March 2012). «Елемейтін тропикалық аурулардың әлемдік ауыртпалығы». Қоғамдық денсаулық сақтау. 126 (3): 233–36. дои:10.1016 / j.puhe.2011.11.015. PMID 22325616.
- ^ "Global network for neglected tropical diseases receives $34 million from Gates Foundation: IDB leads campaign to greatly reduce the burden of most neglected diseases by 2020 in Latin America and the Caribbean." Ұйықтауға бару. Global Network for Neglected Tropical Diseases. 30 қаңтар 2009 ж.
- ^ "Deworm the World at Clinton Global Initiative 2008 Annual Meeting: up to 10 million children to benefit fromdeworming!" Ұйықтауға бару. Deworm the World, 2008.
- ^ Pal D, Chattopadhyay UK, Sengupta G (April 2007). "A study on the prevalence of hookworm infection in four districts of West Bengal and its linkage with anemia". Indian J. Pathol. Микробиол. 50 (2): 449–52. PMID 17883107.
- ^ Gandhi NS, Jizhang C, Khoshnood K, Fuying X, Shanwen L, Yaoruo L, Bin Z, Haechou X, Chongjin T, Yan W, Wensen W, Dungxing H, Chong C, Shuhua X, Hawdon JM, Hotez PJ (August 2001). "Epidemiology of Американдық некатор hookworm infections in Xiulongkan Village, Hainan Province, China: high prevalence and intensity among middle-aged and elderly residents". Дж. Паразитол. 87 (4): 739–43. дои:10.1645/0022-3395(2001)087[0739:EONAHI]2.0.CO;2. PMID 11534635.
- ^ Verle P, Kongs A, De NV, Thieu NQ, Depraetere K, Kim HT, Dorny P (October 2003). "Prevalence of intestinal parasitic infections in northern Vietnam". Троп. Мед. Int. Денсаулық. 8 (10): 961–64. дои:10.1046/j.1365-3156.2003.01123.x. PMID 14516309.
- ^ Fleming FM, Brooker S, Geiger SM, Caldas IR, Correa-Oliveira R, Hotez PJ, Bethony JM (January 2006). "Synergistic associations between hookworm and other helminth species in a rural community in Brazil". Троп. Мед. Int. Денсаулық. 11 (1): 56–64. дои:10.1111/j.1365-3156.2005.01541.x. PMID 16398756. S2CID 20407618.
- ^ Mabaso ML, Appleton CC, Hughes JC, Gouws E (April 2004). "Hookworm (Американдық некатор) transmission in inland areas of sandy soils in KwaZulu-Natal, South Africa". Троп. Мед. Int. Денсаулық. 9 (4): 471–76. дои:10.1111/j.1365-3156.2004.01216.x. PMID 15078265.
- ^ McKenna, Megan L.; McAtee, Shannon; Ходес, Питер Дж.; Bryan, Patricia E.; Jeun, Rebecca; Bottazzi, Maria E.; Flowers, Catherine C.; Ward, Tabitha; Kraus, Jacob; Mejia, Rojelio (8 November 2017). "Human Intestinal Parasite Burden and Poor Sanitation in Rural Alabama". Американдық тропикалық медицина және гигиена журналы. 97 (5): 1623–28. дои:10.4269/ajtmh.17-0396. PMC 5817782. PMID 29016326.
- ^ Pilkington, Ed (5 September 2017). "Hookworm, a disease of extreme poverty, is thriving in the US south. Why?". The Guardian. Алынған 4 желтоқсан 2017 - www.TheGuardian.com арқылы.
- ^ Brooker S, Clements AC, Bundy DA (2006). "Global epidemiology, ecology and control of soil-transmitted helminth infections". Жұқпалы аурулардың жаһандық картасы: әдістері, мысалдары және дамып келе жатқан қосымшалары. Adv. Паразитол. Паразитологияның жетістіктері. 62. 221-61 бет. дои:10.1016/S0065-308X(05)62007-6. ISBN 978-0120317622. PMC 1976253. PMID 16647972.
- ^ Peduzzi R, Piffaretti JC (1983). "Анцилостома он екі елі ішек and the Saint Gothard anaemia". Br Мед. J. (Clin. Res. Ed.). 287 (6409): 1942–45. дои:10.1136/bmj.287.6409.1942. PMC 1550193. PMID 6418279.
- ^ Бет, Уолтер Х. (Қыркүйек 1912). "The Hookworm And Civilization: The Work Of The Rockefeller Sanitary Commission In The Souther States". Әлемдік жұмыс: біздің заманымыздың тарихы. Том. XXIV. pp. 504–18. Алынған 2009-07-10.
- ^ Bleakley H (2007). "Disease and Development: Evidence from Hookworm Eradication in the American South". Q. J. Econ. 122 (1): 73–117. дои:10.1162/qjec.121.1.73. PMC 3800113. PMID 24146438.
- ^ Wallace, Barbara; Kirkley, James; McGuire, Thomas; Austin, Diane; Goldfield, David (April 2001). Assessment of Historical, Social, and Economic Impacts of OCS Development on Gulf Coast Communities (PDF) (Есеп). New Orleans: U .S. Ішкі істер департаменті. Мұхит энергиясын басқару бюросы (BOEM), Minerals Management Service, Gulf of Mexico OCS Region. 35-36 бет. Алынған 11 желтоқсан, 2017.
Inadequate public health services and a general lack of basic citizen knowledge of health and hygiene reflected the weak public education system. Health problems, especially in the Gulf Coast States where frost came late, if at all, abounded in an era when active public health departments in other parts of the country were eradicating nutritional and bacterial diseases. The hookworm, an intestinal parasite, infected and chronically debilitated a great many southerners, perhaps as many as 2 million. In the 1930s, a cooperative study by the Florida State Board of Health, the Rockefeller Foundation, and Vanderbilt University found the State's adolescents aged 15 to 18 the worst afflicted group (44.7 percent), and the Panhandle the most severely affected area with nearly half of its teenagers (49 .2 percent) infested with hookworm (Eberson, 1980; and Link, 1988). John D. Rockefeller found the situation so appalling in the early twentieth century that he established and funded the Rockefeller Sanitary Commission for the Eradication of Hookworm Disease.
- ^ Бирн, Энн-Эмануэль; Solórzano, Armando (November 1999). «Қоғамдық денсаулық сақтау саясатының парадокстары: Рокфеллер қорының ХХ ғасырдың 20-жылдарындағы Мексикадағы анкилостоменттік науқанындағы ғылым және саясат». Soc. Ғылыми. Мед. 49 (9): 1197–1213. дои:10.1016 / S0277-9536 (99) 00160-4. PMID 10501641.
- ^ John A Ferrell (1914). The Rural School and Hookworm Disease. АҚШ үкіметінің баспа кеңсесі.
- ^ а б Брукер, Саймон; Bethony, Jeffrey; Hotez, Peter J. (2004-01-01). Human Hookworm Infection in the 21st Century. Adv. Паразитол. Паразитологияның жетістіктері. 58. pp. 197–288. дои:10.1016/S0065-308X(04)58004-1. ISBN 978-0120317585. ISSN 0065-308X. PMC 2268732. PMID 15603764.
- ^ а б Gyorkos TW, Larocque R, Casapia M, Gotuzzo E (September 2006). "Lack of risk of adverse birth outcomes after deworming in pregnant women". Педиатр. Жұқтыру. Дис. Дж. 25 (9): 791–4. дои:10.1097/01.inf.0000234068.25760.97. PMID 16940835. S2CID 8637824.
- ^ Brooker S, Hotez PJ, Bundy DA (2008). Raso G (ed.). "Hookworm-Related Anaemia among Pregnant Women: A Systematic Review". PLOS Negl. Троп. Дис. 2 (9): e291. дои:10.1371/journal.pntd.0000291. PMC 2553481. PMID 18820740.
- ^ Larocque R, Casapia M, Gotuzzo E, MacLean JD, Soto JC, Rahme E, Gyorkos TW (October 2006). "A double-blind randomized controlled trial of antenatal mebendazole to reduce low birthweight in a hookworm-endemic area of Peru". Троп. Мед. Int. Денсаулық. 11 (10): 1485–95. дои:10.1111/j.1365-3156.2006.01706.x. PMID 17002722. S2CID 46261382.
- ^ а б Salam, RA; Haider, BA; Humayun, Q; Bhutta, ZA (18 June 2015). "Effect of administration of antihelminthics for soil-transmitted helminths during pregnancy". Cochrane жүйелік шолулардың мәліметтер базасы. 6 (6): CD005547. дои:10.1002/14651858.CD005547.pub3. PMID 26087057.
- ^ Brooker S, Akhwale W, Pullan R, Estambale B, Clarke SE, Snow RW, Hotez PJ (December 2007). "Epidemiology of Plasmodium-Helminth co-infection in Africa: Populations at risk, potential impact on anemia and prospects for combining control". Am. Дж. Троп. Мед. Hyg. 77 (6 Suppl): 88–98. дои:10.4269/ajtmh.2007.77.88. PMC 2637949. PMID 18165479.
- ^ Brooker S, Clements AC, Hotez PJ, Hay SI, Tatem AJ, Bundy DA, Snow RW (2006). "The co-distribution of Plasmodium falciparum and hookworm among African schoolchildren". Безгек. Дж. 5: 99. дои:10.1186/1475-2875-5-99. PMC 1635726. PMID 17083720.
- ^ Spiegel A, Tall A, Raphenon G, Trape JF, Druilhe P (2003). "Increased frequency of malaria attacks in subjects co-infected by intestinal worms and Plasmodium falciparum malaria". Транс. R. Soc. Троп. Мед. Hyg. 97 (2): 198–9. дои:10.1016/S0035-9203(03)90117-9. PMID 14584377.
- ^ Knowles SC (August 2011). "The effect of helminth co-infection on malaria in mice". Int. Дж. Паразитол. 41 (10): 1041–51. дои:10.1016/j.ijpara.2011.05.009. PMID 21777589.
- ^ Mwangi TW, Bethony JM, Brooker S (October 2006). "Malaria and helminth interactions in humans: an epidemiological viewpoint". Энн. Троп. Мед. Паразитол. 100 (7): 551–70. дои:10.1179/136485906X118468. PMC 1858631. PMID 16989681.
- ^ Hartgers FC, Yazdanbakhsh M (October 2006). "Co-infection of helminths and malaria: modulation of the immune responses to malaria". Parasite Immunol. 28 (10): 497–506. дои:10.1111/j.1365-3024.2006.00901.x. PMID 16965285. S2CID 20956686.
- ^ Strachan DP (November 1989). "Hay fever, hygiene, and household size". BMJ. 299 (6710): 1259–60. дои:10.1136/bmj.299.6710.1259. PMC 1838109. PMID 2513902.
- ^ Cooper PJ (2004). "Intestinal worms and human allergy". Parasite Immunol. 26 (11–12): 455–67. дои:10.1111/j.0141-9838.2004.00728.x. PMID 15771681. S2CID 23348293.
- ^ а б Diemert, David J.; Bethony, Jeffrey M.; Hotez, Peter J. (15 January 2008). "Hookworm Vaccines". Клиника. Жұқтыру. Дис. 46 (2): 282–8. дои:10.1086/524070. ISSN 1058-4838. JSTOR 40306890. PMID 18171264.
- ^ Bethony JM, Simon G, Diemert DJ, Parenti D, Desrosiers A, Schuck S, Fujiwara R, Santiago H, Hotez PJ (May 2008). "Randomized, placebo-controlled, double-blind trial of the Na-ASP-2 hookworm vaccine in unexposed adults". Вакцина. 26 (19): 2408–17. дои:10.1016/j.vaccine.2008.02.049. PMID 18396361.
- ^ Williamson AL, Lecchi P, Turk BE, Choe Y, Hotez PJ, McKerrow JH, Cantley LC, Sajid M, Craik CS, Loukas A (August 2004). "A multi-enzyme cascade of hemoglobin proteolysis in the intestine of blood-feeding hookworms". Дж.Биол. Хим. 279 (34): 35950–7. дои:10.1074/jbc.M405842200. PMID 15199048.
- ^ а б c Loukas A, Bethony JM, Mendez S, Fujiwara RT, Goud GN, Ranjit N, Zhan B, Jones K, Bottazzi ME, Hotez PJ (October 2005). "Vaccination with Recombinant Aspartic Hemoglobinase Reduces Parasite Load and Blood Loss after Hookworm Infection in Dogs". PLOS Med. 2 (10): e295. дои:10.1371/journal.pmed.0020295. PMC 1240050. PMID 16231975.
- ^ а б Лукас, Алекс; Bethony, Jeffrey M.; Williamson, Angela L.; Goud, Gaddam N.; Mendez, Susana; Zhan, Bin; Hawdon, John M.; Боттадзи, Мария Елена; Бриндли, Пол Дж.; Hotez, Peter J. (15 May 2004). "Vaccination of Dogs with a Recombinant Cysteine Protease from the Intestine of Canine Hookworms Diminishes the Fecundity and Growth of Worms". J. жұқтырыңыз. Дис. 189 (10): 1952–61. дои:10.1086/386346. ISSN 0022-1899. JSTOR 30077095. PMID 15122534.
- ^ Zhan B, Liu S, Perally S, Xue J, Fujiwara R, Brophy P, Xiao S, Liu Y, Feng J, Williamson A, Wang Y, Bueno LL, Mendez S, Goud G, Bethony JM, Hawdon JM, Loukas A, Jones K, Hotez PJ (October 2005). "Biochemical Characterization and Vaccine Potential of a Heme-Binding Glutathione Transferase from the Adult Hookworm Ancylostoma caninum". Жұқтыру. Иммун. 73 (10): 6903–11. дои:10.1128 / IAI.73.10.6903-6911.2005. PMC 1230892. PMID 16177370.
Сыртқы сілтемелер
- CDC Department of Parasitic Diseases images of the hookworm life cycle
- Ауруларды бақылау және алдын алу орталықтары
- Dog hookworm (Ancylostoma caninum) at MetaPathogen: facts, life cycle, references
- Human hookworms (Анцилостома он екі елі ішек және Американдық некатор) at MetaPathogen: facts, life cycle, references
| Жіктелуі |
|---|

