Гемцитабин - Gemcitabine
 | |
 | |
| Клиникалық мәліметтер | |
|---|---|
| Айтылым | /dʒɛмˈсaɪтəбменn/ |
| Сауда-саттық атаулары | Гемзар, басқалары[1] |
| Басқа атаулар | 2 ', 2'-дифлюоро 2'дезокситидин, dFdC |
| AHFS /Drugs.com | Монография |
| Жүктілік санат |
|
| Маршруттары әкімшілік | Тамырішілік |
| ATC коды | |
| Құқықтық мәртебе | |
| Құқықтық мәртебе | |
| Фармакокинетикалық деректер | |
| Ақуыздармен байланысуы | <10% |
| Жою Жартылай ыдырау мерзімі | Қысқа инфузиялар: 32-94 минут Ұзақ инфузиялар: 245-68 минут |
| Идентификаторлар | |
| |
| CAS нөмірі | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Чеби | |
| ЧЕМБЛ | |
| CompTox бақылау тақтасы (EPA) | |
| ECHA ақпарат картасы | 100.124.343 |
| Химиялық және физикалық мәліметтер | |
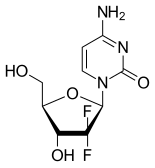
| Формула | C9H11F2N3O4 |
| Молярлық масса | 263.201 г · моль−1 |
| 3D моделі (JSmol ) | |
| |
| |
| (тексеру) | |
Гемцитабин, сауда маркасымен сатылады Гемзар, басқалардың арасында,[1] Бұл химиялық терапия бірқатар түрлерін емдеу үшін қолданылады қатерлі ісік.[2] Бұл қатерлі ісік ауруларына жатады сүт безі қатерлі ісігі, аналық без қатерлі ісігі, кіші жасушалы емес өкпе рагы, ұйқы безі қатерлі ісігі, және қуық қатерлі ісігі.[2][3] Оны береді тамырға баяу инъекция.[2]
Жалпы жанама әсерлерге мыналар жатады сүйек кемігін басу, бауыр мен бүйрек проблемалары, жүрек айну, безгегі, бөртпе, ентігу, ауыз қуысы, диарея, невропатия және шаштың түсуі.[2] Кезінде қолданыңыз жүктілік нәрестеге зиян келтіруі мүмкін.[2] Гемцитабин аналогты нуклеозид дәрі-дәрмектер отбасы.[2] Ол жаңа құрылғыны бұғаттау арқылы жұмыс істейді ДНҚ бұл жасушалардың өлуіне әкеледі.[2]
Гемцитабин 1983 жылы патенттелген және 1995 жылы медициналық қолдануға рұқсат етілген.[4] Жалпы нұсқалар Еуропада 2009 жылы, ал АҚШ-та 2010 жылы енгізілді.[5][6] Бұл Дүниежүзілік денсаулық сақтау ұйымының маңызды дәрі-дәрмектер тізімі.[7]
Медициналық қолдану
Гемцитабин әр түрлі қолданылады карциномалар. Ол тек бірінші қатардағы емдеу ретінде қолданылады ұйқы безі қатерлі ісігі, және бірге цисплатин жетілдірілген немесе метастатикалық үшін қуық қатерлі ісігі және дамыған немесе метастатикалық кіші жасушалы емес өкпе рагы. Ол екінші қатарлы емдеу әдісімен бірге қолданылады карбоплатин үшін аналық без қатерлі ісігі және бірге паклитаксел үшін сүт безі қатерлі ісігі метастатикалық немесе хирургиялық жолмен жою мүмкін емес.[8][9][10]
Ол әдетте қолданылады жапсырмадан тыс емдеу холангиокарцинома[11] және басқа да өт жолдары қатерлі ісік.[12]
Ол венаға а-да инъекция арқылы беріледі химиотерапия клиника.[2]
Қарсы көрсеткіштер және өзара әрекеттесу
Гемцитабинді қабылдау ерлер мен әйелдердегі құнарлылыққа, жыныстық өмірге және етеккірге әсер етуі мүмкін. Гемцитабин қабылдайтын әйелдер жүкті болмауы керек, ал жүкті және емізетін әйелдер оны қабылдамауы керек.[13]
2014 жылдан бастап дәрі-дәрмектермен өзара әрекеттесу зерттелмеген.[9][8]
Жағымсыз әсерлер
Гемцитабин - бұл а химиотерапия бөлінетін кез-келген жасушаны өлтіру арқылы жұмыс жасайтын дәрі.[8] Қатерлі ісік жасушалары тез бөлінеді, сондықтан гемцитабиннің әсерінен жоғары жылдамдықта жүреді, бірақ көптеген маңызды жасушалар тез бөлінеді, соның ішінде терінің, бастың терісінің, асқазанның қабаты мен сүйек майының жасушалары, нәтижесінде жағымсыз әсерлер пайда болады.[14]:265
Гемцитабин затбелгісінде сүйек кемігінің қызметі мен себептерін тоқтата алатындығы туралы ескертулер бар лейкоциттердің жоғалуы, тромбоциттердің жоғалуы, және қызыл қан жасушаларының жоғалуы және оны бауыр, бүйрек немесе жүрек-қан тамырлары аурулары бар адамдарға мұқият қолдану керек. Оны қолданатын адамдар тірі вакциналарды қабылдамауы керек. Ескерту жапсырмасында оның пайда болуы мүмкін екендігі де көрсетілген артқы қалпына келетін энцефалопатия синдромы, бұл себеп болуы мүмкін капиллярлық ағып кету синдромы сияқты ауыр өкпе жағдайларын тудыруы мүмкін өкпе ісінуі, пневмония, және ересек адамның тыныс алу синдромы және бұл сперматозоидтарға зиян тигізуі мүмкін.[8][15]
Өте жиі кездесетін (адамдардың 10% -дан астамы оларды дамытады) жағымсыз әсерлерге тыныс алудың қиындауы, ақ және эритроциттердің төмен мөлшері және тромбоциттер санының төмендеуі, құсу және жүрек айнуы, көтерілген трансаминазалар, терінің қышуы, қышуы, шаштың түсуі, зәрдегі қан мен ақуыз, тұмауға ұқсас белгілер және ісіну.[8][13]
Жалпы қолайсыз әсерлерге (адамдардың 1-10% -ында байқалады) дене қызуы, тәбеттің төмендеуі, бас ауруы, ұйқының қиындауы, шаршау, жөтел, мұрыннан су ағу, диарея, ауыз және ерін жаралары, тершеңдік, арқа ауруы және бұлшықет ауруы жатады.[8]
Тромбоздық тромбоцитопениялық пурпура (TTP) сирек кездеседі, бірақ бұл гемцитабинмен, сондай-ақ басқа да кейбір химиялық терапия дәрілерімен байланысты жанама әсері. TTP қанның бұзылуы болып табылады және оның пайда болуына әкелуі мүмкін микроангипатиялық гемолитикалық анемия (MAHA), неврологиялық ауытқулар, безгегі және бүйрек аурулары.[16]
Фармакология
Гемцитабин болып табылады гидрофильді және үшін жасушаларға молекулалық тасымалдағыштар арқылы тасымалдау керек нуклеозидтер (гемцитабиннің ең көп таралған тасымалдаушылары SLC29A1 SLC28A1 және SLC28A3).[17][18] Ұяшыққа енгеннен кейін гемцитабин а-ны қосу арқылы өзгертіледі фосфат ол гемцитабин монофосфатына (dFdCMP) айналады.[17][18] Бұл ставканы анықтайтын қадам деп катализдейді фермент дезокситидин киназасы (DCK).[17][18] Басқа ферменттер тағы екі фосфатты қосады. Үш фосфат қосылғаннан кейін гемцитабин фармакологиялық тұрғыдан гемцитабин трифосфаты (dFdCTP) ретінде белсенді болады.[17]
Үш рет болғаннан кейін фосфорланған, гемцитабинді маскарадтауға болады дезоксицитидин трифосфаты және жасуша ретінде синтезделетін жаңа ДНҚ тізбектеріне қосылады көшірмелер.[2][17][18]
Гемцитабин ДНҚ-ға енгізілгенде, оның жанына табиғи немесе қалыпты түрде нуклеозид негізін қосуға мүмкіндік береді. Бұл гемцитабин «ақаулы» негіз болып табылатындықтан, «маскаланған тізбектің үзілуіне» әкеледі, бірақ өзінің табиғи нуклеозидіне байланысты жасушаның қалыпты қалпына келтіру жүйесінен қашып кетеді (экзиздік-базалық жөндеу ). Осылайша, гемцитабинді жасушаның ДНҚ-на енгізу одан әрі ДНҚ синтезінің тежелуіне алып келетін және сол арқылы жасушаның өліміне алып келетін жөнделмейтін қателік тудырады.[2][17][18]
Екі фосфаты бар гемцитабиннің (dFdCDP) формасы да белсенділікке ие; ол ферментті тежейді рибонуклеотид-редуктаза (RNR), ол жаңа ДНҚ нуклеотидтерін құру үшін қажет. Нуклеотидтердің жетіспеушілігі жасушаны жасушадан тыс нуклеотидтер жасау үшін қажет компоненттерді көбірек алуға итермелейді, бұл гемцитабиннің де сіңуін арттырады.[2][17][18][19]
Химия
Гемцитабин синтетикалық болып табылады пиримидин нуклеозид есірткі —А аналогты нуклеозид онда сутегі атомдар көміртегінің 2 ' дезоксицитидин ауыстырылады фтор атомдар[2][20][21]
Төменде сипатталған және суреттелген синтез - бұл Eli Lilly Company зертханаларында жасалған түпнұсқа синтез. Синтез D-глицеральдегид (R) -2 энантиопурасынан басталады, оны бастапқы материал ретінде D-маннитолдан 2–7 сатыда жасауға болады. Содан кейін фтор этил бромодифлуроацетатты қолданумен «құрылыс материалы» тәсілімен енгізіледі. Сонда Реформацкий реакциясы стандартты жағдайда 3: 1 анти / син диастереомерлі қоспасын береді, бір негізгі өніммен. Диастереомерлерді бөлу HPLC арқылы жүзеге асырылады, осылайша анти-3 гемцитабин 65% өнімділік береді.[20][21] Кем дегенде екі толық синтез әдісі де әр түрлі топтармен жасалған.[21]

Тарих
Гемцитабин алғаш рет синтезделген Ларри Хертель зертханасы Эли Лилли және Компания 1980 жылдардың басында. Ол ретінде қарастырылған вирусқа қарсы препарат, бірақ клиникаға дейінгі тестілеу оның лейкемия жасушаларын өлтіргенін көрсетті in vitro.[22]
1990 жылдардың басында гемцитабин клиникалық зерттеулерде зерттелді. Панкреатикалық қатерлі ісікке қарсы зерттеулер гемцитабиннің бір жылдық өмір сүру уақытын едәуір арттырғанын анықтады және ол Ұлыбританияда 1995 жылы мақұлданды[8] және FDA 1996 жылы ұйқы безі қатерлі ісіктері үшін мақұлдады.[3] 1998 жылы гемцитабин ұсақ жасушалы емес өкпенің қатерлі ісігін емдеу үшін FDA мақұлдауын алды, ал 2004 жылы сүт безінің метастатикалық қатерлі ісігінен мақұлданды.[3]
Еуропалық жапсырмалар 2008 жылы EMA-мен үйлестірілген.[23]
2008 жылға қарай Lilly-дің гемцитабиннің дүниежүзілік сатылымы шамамен 1,7 миллиард долларды құрады; сол кезде оның АҚШ-тағы патенттері 2013 жылы, ал еуропалық патенттер 2009 жылы аяқталуы керек болатын.[24] Еуропада 2009 жылы тұңғыш шығарылған,[5] және патенттік проблемалар АҚШ-та пайда болды, бұл есірткіні жасау әдісіне негізделген Lilly патентінің жарамсыздығына әкелді.[25][26] Жалпы компаниялар препаратты АҚШ-та 2010 жылы химикаттың патентінің мерзімі аяқталғаннан кейін сата бастады.[26][6] Қытайдағы патенттік сот ісі сол жерде үлкен тақырыптарға айналды және 2010 жылы шешілді.[27]
Қоғам және мәдениет
2017 жылдан бастап гемцитабин әлемдегі көптеген брендтермен сатылды: Абин, Аккогем, Ацитабин, Анторил, акигем, Бендацитабин, Биогем, Болигем, Селзар, Цитегин, Цитигем, Цитогем, Даплакс, ДБЛ, Демозар, Дерцин, Эммитаб, Энекамуб, Эрио , Fotinex, Gebina, Gemalata, Gembin, Gembine, Gembio, Gemcel, Gemcetin, Gemcibine, Gemcikal, Gemcipen, Gemcired, Gemcirena, Gemcitabina, Gemcitabine, Gemcitememem, Gemcitememem, Gemcitemem, , Gemmis, Gemnil, Gempower, Gemsol, Gemstad, Gemstada, Gemtabine, Gemtavis, Gemtaz, Gemtero, Gemtra, Gemtro, Gemvic, Gemxit, Gemzar, Gentabim, Genuten, Genvir, Geroam, Gestredos, Getem, Gestredos, Getem , Хаксанит, Джемта, Калбезар, Медигем, Медитабин, Набигем, Наллиан, Онкогем, Онкорил, Памигено, Рибозар, Сантабин, Ситагем, Сымтабин, Ю Цзе, Цзе Фэй және Зефей.[1]
Зерттеу
Бұл клиникалық тұрғыдан құнды және тамырға жібергенде ғана пайдалы болғандықтан, оны ауызша бере алатындай етіп қайта құру әдістері зерттеу тақырыбы болды.[28][29][30]
Ішіндегі зерттеу фармакогеномика және фармакогенетика жалғасып келеді. 2014 жылдан бастап генетикалық сынақтардың дозалауды басқаруда пайдалы болуы немесе болмауы және гемцитабинге қай адамдар жақсы әсер ететіндігі белгісіз болды.[17] Алайда, ақуыздардың экспрессиясының өзгеруі (SLC29A1, SLC29A2, SLC28A1, және SLC28A3 ) гемцитабинді жасушаға тасымалдау үшін қолданылады, оның күшінің өзгеруіне әкеледі. Сол сияқты, оның инактивациясына әкелетін ақуыздарды білдіретін гендер (дезокситидин дезаминазы, цитидин-дезиназа, және NT5C ) және оның басқа жасуша ішілік мақсаттарын білдіретін (RRM1, RRM2, және RRM2B ) препаратқа жауап ретінде вариацияларға әкеледі.[17] Ұйқы безі қатерлі ісіктеріндегі мутациялардың гемцитабинге реакцияны қалай анықтайтындығын түсіну үшін зерттеулер де жалғасып келеді.[31]
Бұл емдеу әдісі ретінде зерттелген Капоси саркомасы, бар адамдарда кең таралған қатерлі ісік ЖИТС дамыған әлемде сирек кездесетін, бірақ дамушы елдерде сирек кездесетін жағдай.[32]
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ а б в «Gemcitabine халықаралық брендтері». Drugs.com. Мұрағатталды түпнұсқасынан 2014 жылғы 25 мамырда. Алынған 6 мамыр 2017.
- ^ а б в г. e f ж сағ мен j к л «Гемцитабин гидрохлориді». Американдық денсаулық сақтау жүйесі фармацевтер қоғамы. Мұрағатталды түпнұсқадан 2017 жылғы 2 ақпанда. Алынған 8 желтоқсан 2016.
- ^ а б в Ұлттық онкологиялық институт (2006-10-05). «Гемцитабин гидрохлоридіне FDA келісімі». Ұлттық онкологиялық институт. Мұрағатталды түпнұсқадан 2017 жылғы 5 сәуірде. Алынған 22 сәуір 2017.
- ^ Фишер Дж, Ганелллин CR (2006). Аналогты негіздегі есірткіні табу. Джон Вили және ұлдары. б. 511. ISBN 9783527607495.
- ^ а б Майерс, Калиша (13 наурыз 2009). «Актавистен шыққан гемситабин ЕО нарықтарында патенттің қолданылу мерзімі аяқталғаннан кейін іске қосылды». FierceBiotech. Мұрағатталды түпнұсқадан 11 қыркүйек 2017 ж.
- ^ а б «Пресс-релиз: Хоспира инъекцияға арналған гемцитабин гидрохлоридінің екі грамм құтын шығарады». Хоспира News-Medical.Net арқылы. 16 қараша 2010 ж. Мұрағатталды түпнұсқадан 2015 жылғы 2 қазанда.
- ^ Дүниежүзілік денсаулық сақтау ұйымы (2019). Дүниежүзілік денсаулық сақтау ұйымы маңызды дәрілік заттардың тізімі: 2019 жылғы 21-ші тізім. Женева: Дүниежүзілік денсаулық сақтау ұйымы. hdl:10665/325771. ДДСҰ / MVP / EMP / IAU / 2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ а б в г. e f ж «UK label». Ұлыбританиядағы электронды дәрі-дәрмектер бойынша жинақ. 5 маусым 2014. мұрағатталған түпнұсқа 10 шілде 2017 ж. Алынған 6 мамыр 2017.
- ^ а б «АҚШ этикеткасы» (PDF). FDA. Маусым 2014. Мұрағатталды (PDF) түпнұсқадан 2017 жылғы 16 ақпанда. Алынған 6 мамыр 2017. Жапсырманың жаңартуларын қараңыз NDA 020509 арналған FDA индексінің беті Мұрағатталды 2017-04-29 сағ Wayback Machine
- ^ Чжан XW, Ma YX, Sun Y, Cao YB, Li Q, Xu CA (маусым 2017). «Жергілікті деңгейде дамыған немесе метастатикалық панкреатикалық қатерлі ісікті бірінші сатыдағы емдеу кезінде екінші цитотоксикалық агентпен үйлескен гемситабин: жүйелік шолу және мета-талдау». Мақсатты онкология. 12 (3): 309–321. дои:10.1007 / s11523-017-0486-5. PMID 28353074. S2CID 3833614.
- ^ Plentz RR, Malek NP (желтоқсан 2016). «Холангиокарциноманың жүйелік терапиясы». Висцеральды медицина. 32 (6): 427–430. дои:10.1159/000453084. PMC 5290432. PMID 28229078.
- ^ Джейн А, Квонг Л.Н., Джавле М (қараша 2016). «Билиарлы тракт қатерлі ісіктерінің геномдық профилі және клиникалық практикаға салдары». Онкологиядағы емдеудің қазіргі нұсқалары. 17 (11): 58. дои:10.1007 / s11864-016-0432-2. PMID 27658789. S2CID 25477593.
- ^ а б Макмилланның қатерлі ісік ауруын қолдау. «Гемцитабин». Макмилланның қатерлі ісік ауруын қолдау. Мұрағатталды түпнұсқадан 2017 жылғы 25 наурызда. Алынған 6 мамыр 2017.
- ^ Рейчел Эйрли (2009). Қатерлі ісік химиотерапиясы. Уили-Блэквелл. ISBN 978-0-470-09254-5.
- ^ Сиддалл Э, Хатри М, Радхакришнан Дж (шілде 2017). «Капиллярлық ағып кету синдромы: этиология, патофизиология және басқару». Халықаралық бүйрек. 92 (1): 37–46. дои:10.1016 / j.kint.2016.11.029. PMID 28318633.
- ^ Kasi PM (қаңтар 2011). «Тромботикалық тромбоцитопениялық пурпура және гемцитабин». Онкологиядағы есептер. 4 (1): 143–8. дои:10.1159/000326801. PMC 3114619. PMID 21691573.
- ^ а б в г. e f ж сағ мен Alvarellos ML, Lamba J, Sangkuhl K, Thorn CF, Wang L, Klein DJ, Altman RB, Klein TE (қараша 2014). «PharmGKB қысқаша мазмұны: гемцитабин жолы». Фармакогенетика және геномика. 24 (11): 564–74. дои:10.1097 / fpc.000000000000000086. PMC 4189987. PMID 25162786.
- ^ а б в г. e f Mini E, Nobili S, Caciagli B, Landini I, Mazzei T (мамыр 2006). «Гемцитабиннің жасушалық фармакологиясы». Онкология шежіресі. 17 Қосымша 5: v7-12. дои:10.1093 / annonc / mdj941. PMID 16807468.
- ^ Cerqueira NM, Fernandes PA, Ramos MJ (2007). «Ремонуклеотид-редуктазаның гемцитабинмен инактивациялануы туралы түсінік». Химия. 13 (30): 8507–15. дои:10.1002 / хим.200700260. PMID 17636467.
- ^ а б Браун К, Веймут-Уилсон А, Линклау Б (сәуір 2015). «Гемцитабиннің сызықтық синтезі». Көмірсуларды зерттеу. 406: 71–5. дои:10.1016 / j.carres.2015.01.001. PMID 25681996.
- ^ а б в Браун К, Дикси М, Веймут-Уилсон А, Линклау Б (наурыз 2014). «Гемцитабин синтезі». Көмірсуларды зерттеу. 387: 59–73. дои:10.1016 / j.carres.2014.01.024. PMID 24636495.
- ^ Sneader, Walter (2005). Есірткіні табу: тарих. Нью-Йорк: Вили. б. 259. ISBN 978-0-471-89979-2.
- ^ «Гемзар». Еуропалық дәрі-дәрмек агенттігі. 24 қыркүйек 2008 ж. Мұрағатталды түпнұсқадан 11 қыркүйек 2017 ж.
- ^ Майерс, Калиша (18 тамыз 2009). «Лиллидің рак ауруы Гемзарға арналған патент жарамсыз». FiercePharma. Мұрағатталды түпнұсқадан 11 қыркүйек 2017 ж.
- ^ Холман, Кристофер М. (2011 ж. Жаз). «Патенттік заңдағы болжамсыздық және оның фармацевтикалық инновацияға әсері» (PDF). Миссури шолу. 76 (3): 645-693. Архивтелген түпнұсқа (PDF) 2017-09-11. Алынған 2017-05-06.
- ^ а б Равичер, Даниэль Б. (28 шілде 2010). «Гемзардың жалпы патенттік ұрысы туралы». Альфаны іздеуде. Мұрағатталды 2012 жылғы 9 желтоқсандағы түпнұсқадан.
- ^ Ванг М, Александр Д (2015). «Ұлы Қытайдағы фармацевтикалық патенттің бұзылу жағдайларын талдау». Rader RR және т.б. (ред.). Зияткерлік меншік саласындағы құқық, саясат және кірістерді өндіру. Кембридж ғалымдарының баспасы. б. 119. ISBN 9781443879262. Мұрағатталды түпнұсқасынан 2017-09-11.
- ^ Dyawanapelly S, Kumar A, Chourasia MK (2017). «Гемцитабиннен алған сабақ: терапиялық тасымалдаушы жүйелер мен гемцитабиннің есірткі конъюгаттарының қатерлі ісік терапиясына әсері». Терапевтік дәрі-дәрмектерді тасымалдау жүйесіндегі сыни шолулар. 34 (1): 63–96. дои:10.1615 / CritRevTherDrugCarrierSyst.2017017912. PMID 28322141.
- ^ Birhanu G, Javar HA, Seyedjafari E, Zandi-Karimi A (сәуір 2017). «Ұйқы безінің қатерлі ісігін емдеу үшін гемцитабинді жеткізуге арналған нанотехнологиялар». Биомедицина және фармакотерапия. 88: 635–643. дои:10.1016 / j.biopha.2017.01.071. PMID 28142120.
- ^ Dubey RD, Saneja A, Gupta PK, Gupta PN (қазан 2016). «Гемцитабиннің терапевтік тиімділігін жақсарту бойынша дәрі-дәрмектерді жеткізу стратегиясының соңғы жетістіктері». Еуропалық фармацевтикалық ғылымдар журналы. 93: 147–62. дои:10.1016 / j.ejps.2016.08.021. PMID 27531553.
- ^ Пишваян МДж, Броуди JR (наурыз 2017). «Ұйқы безінің қатерлі ісік ауруына молекулалық кіші түрлендірудің терапиялық әсері». Онкология. 31 (3): 159–66, 168. PMID 28299752. Мұрағатталды түпнұсқадан 2017 жылғы 3 шілдеде.
- ^ Krown SE (қыркүйек 2011). «Сахараның оңтүстігінде Африкадағы Капоши саркомасын емдеу стратегиялары: қиындықтар мен мүмкіндіктер». Онкологиядағы қазіргі пікір. 23 (5): 463–8. дои:10.1097 / cco.0b013e328349428d. PMC 3465839. PMID 21681092.
Сыртқы сілтемелер
- «Гемцитабин». Есірткі туралы ақпарат порталы. АҚШ ұлттық медицина кітапханасы.
