Малолактикалық ашыту - Malolactic fermentation

Малолактикалық ашыту (сонымен бірге малолактикалық конверсия немесе MLF) бұл процесс шарап жасау онда тарт - дәмін тату алма қышқылы, табиғи түрде бар жүзім керек, жұмсақ дәмге айналады сүт қышқылы. Малолактикалық ашыту көбінесе а түрінде орындалады қайталама ашыту праймериз аяқталғаннан кейін көп ұзамай ашыту, бірақ кейде онымен қатар жүруі мүмкін. Процесс қызыл шарап өндірісінің көпшілігінде стандартты, ал кейбіреулері үшін кең таралған жүзім сорттары сияқты Шардоне, онда ол «май» хош иісін бере алады диацетил, реакцияның қосымша өнімі.[1]
Ферменттеу реакциясын отбасы сүт қышқылы бактериялары (LAB); Oenococcus oeni, және әр түрлі түрлері Лактобакиллус және Педиококк. Химиялық тұрғыдан, мололактикалық ашыту а декарбоксилдену, білдіреді Көмір қышқыл газы барысында босатылады.[2][3]
Барлық осы бактериялардың негізгі қызметі - екі ірі жүзімнің бірі L-алма қышқылын конверсиялау шарапта кездесетін қышқылдар, қышқылдың басқа түріне, L + сүт қышқылына. Бұл табиғи түрде болуы мүмкін. Алайда, коммерциялық шарап өндірісінде малолактикалық конверсия әдетте егу әдетте, қажет бактериялар O. oeni. Бұл жағымсыз бактериялық штамдардың «өшіретін» хош иістерді шығаруына жол бермейді. Керісінше, коммерциялық шарап өндірушілер малолактикалық конверсияны қаламаған кезде, мысалы, жемісті және гүлді ақ жүзім сорттарымен белсенді түрде алдын алады. Рислинг және Gewürztraminer, дайын шарапта қытырлақ немесе қышқыл профильді сақтау үшін.[4][5]
Малолактикалық ашыту дөңгелек, толығырақ жасауға бейім ауызды сезу. Алма қышқылы әдетте жасыл дәммен байланысты алма, сүт қышқылы бай және майдың дәмі көп. Салқын аймақтарда өндірілген жүзімнің қышқылдығы жоғары болады, оның көп бөлігі алма қышқылының үлесінен шығады. Малолактикалық ашыту көбінесе оны күшейтеді дене және хош иіс табандылық шарап, таңдайдың жұмсақтылығы жоғары шараптар шығарады. Көптеген шарап өндірушілер сонымен қатар жемістердің жақсы интеграциясы деп санайды емен сипаты егер шарап бөшкеде болған кезде мололактикалық ашыту пайда болса.[6]
Малолактикалық конверсияға ұшыраған шарап бактериялардың болуына байланысты бұлтты болады және олардың иісі болуы мүмкін сары май Попкорн, диацетил өндірісінің нәтижесі. Бөтелкедегі малолактикалық ашытудың басталуы әдетте а деп саналады шарап ақаулығы, өйткені шарап тұтынушыға әлі де ашыған болып көрінеді (СО нәтижесінде)2 өндіріліп жатыр).[7] Алайда, ерте Винхо-Верде өндіріс, бұл аз көпіршік айырмашылығы бар деп саналды Португал шарабы өндірушілерге шарапты сатуға тура келді мөлдір емес өсуіне байланысты бөтелкелер лайлану және «бөтелкедегі MLF» шығарған шөгінді. Бүгінгі таңда Vinho Verde өндірушілерінің көпшілігі бұл тәжірибені қолданбайды және оның орнына жасанды жолмен аздап жарқыл қосып, құюға дейін малолактикалық ашытуды аяқтайды. карбонизация.[8]
Тарих

Малолактикалық ашыту, мүмкін, ескі шарап тарихы, бірақ MLF-дің оң артықшылықтарын ғылыми тұрғыдан түсіну және процесті бақылау салыстырмалы түрде жақында пайда болды. Көптеген ғасырлар бойы шарап жасаушылар келесі жылы көктем айларында бөшкеде сақталған шараптарында болатын «белсенділікті» байқады. егін. Алғашқы алкогольдік ашыту сияқты, бұл құбылыс көмірқышқыл газын шығарады және шарапта қатты өзгеріс болатын сияқты, ол әрдайым құптала бермейді.[6] Оны 1837 жылы неміс энологы «екінші ашыту» деп сипаттады Freiherr von Babo және өсу себебі лайлану шарапта. Фон Бабо шарап жасаушыларды осы әрекетті көргенде жылдам әрекет етуге шақырды сөре шарапты жаңа бөшкеге құйып күкірт диоксиді, содан кейін тағы бір сөрелер мен күкірттеу жиынтығын қадағалаңыз шарапты тұрақтандыру.[9]
1866 жылы, Луи Пастер, заманауи бастаушылардың бірі микробиология, алғашқы бактерияларды шараптан бөліп алып, шараптағы барлық бактериялардың себебі болғанын анықтады шараптың бұзылуы. Пастер сүт бактерияларымен шарапта қышқылдың азаюын байқаған кезде, ол бұл процесті бактериялардың алма қышқылын тұтынуымен байланыстырмады, керісінше, бұл жай ғана тартрат атмосфералық жауын-шашын.[6] 1891 жылы швейцариялық энолог Герман Мюллер бұл азаюдың себебі бактериялар болуы мүмкін деген теорияны алға тартты. Мюллер өзінің құрдастарының көмегімен 1913 жылы «биологиялық деаксидация» теориясын шарап бактериясы тудырады деп түсіндірді Бактериялар.[9]
1930 жылдары француз энологы Жан Риберо-Гайон шараптағы осы бактериялық трансформацияның артықшылықтары туралы жазылған мақалалар.[6] 1950 жылдардың ішінде жетістіктер ферментативті талдау энологтарға мололактикалық ашытудың артындағы химиялық процестерді жақсы түсінуге мүмкіндік берді. Эмиль Пейно әрі қарай энология процесті түсіну және көп ұзамай пайдалы сүт қышқылы бактерияларының өсірілген қоры шарап өндірушілері үшін қол жетімді болды.[9]
Шарап жасаудағы рөлі
Малолактикалық ашытудың негізгі рөлі - шарапты қышқылсыздандыру.[6] Бұл сонымен қатар шараптың сенсорлық аспектілеріне әсер етуі мүмкін ауызды сезу тегіс болып көрінеді және хош иістендіргіштікке күрделілік қосады шарап хош иісі. Осы басқа себептер бойынша бүкіл әлемдегі қызыл шараптардың көпшілігі (сонымен қатар көптеген) жарқыраған шараптар және әлемдегі ақ шараптардың шамамен 20%) бүгінде мололактикалық ашыту арқылы өтеді.[3]
Малолактикалық ашыту шарапты «қатал» түріне айналдырып, қышқылсыздандырады дипротикалық алма қышқылы жұмсақ монопротикалық сүт қышқылы. Алма және сүт қышқылдарының әртүрлі құрылымдары оның төмендеуіне әкеледі титрленетін қышқылдық (ТА) шарапта 1-ден 3 г / л-ға дейін және ұлғаюы рН 0,3 бірлікке.[5] Алма қышқылы жүзім құрамында болады вегетациялық кезең, шыңына жету вераэрон және біртіндеп азаяды пісу процесі. Салқын климаттан жиналған жүзімнің құрамында алма мөлшері жоғары және малолактикалық ашытудан кейін TA және рН деңгейінің ең үлкен өзгерістері болады.[6]

Малолактикалық ашыту шарапты «микробиологиялық тұрғыдан тұрақты» етуге көмектеседі, өйткені сүт қышқылы бактериялары басқа бұзылған микробтардың шарап ақауларын дамытуда қолдануы мүмкін көптеген қоректік заттарды тұтынады. Сонымен қатар, ол рН-ның жоғарылауына байланысты шарапты аздап «тұрақсыз» етуі мүмкін, әсіресе егер шарап рН шарапының ең жоғарғы деңгейінде болса. Шарап өндірушілерге қышқылдықты көбіне қосу үшін малолактикалық ашыту арқылы «қышқылсыздандыру» әдеттегідей емес (әдетте шарап қышқылы рН-ны тұрақты деңгейге дейін төмендету үшін.[8]
Маликаның лактикалық түрге ауысуы
Сүт қышқылы бактериялары алма қышқылын бактериялар үшін энергия құрудың жанама құралы ретінде сүт қышқылына айналдырады химиосмоз айырмашылықты қолданады рН градиенті жасуша ішіндегі және сыртындағы шараптың арасында өндіріледі ATP. Мұның қалай жүзеге асырылатындығы туралы бір модель шараптың рН төмен болған жағдайда L-малаттың формасы оның теріс зарядталғанын ескертеді. моноанионды форма. Бактериялар бұл анионды шараптан оның рН деңгейіне көтеріп, оның плазмалық жасушасының клеткасына көшкенде, бұл теріс теріс заряд тудырады. электрлік потенциал. Малаттың L-сүт қышқылына декарбоксилденуі көмірқышқыл газын ғана емес, сонымен қатар АТФ түзе алатын рН градиентін түзетін протонды да тұтынады.[2]
Сүт қышқылы бактериялары шарап жүзімінде табиғи түрде кездесетін L-алма қышқылын айналдырады. Алма қышқылының көптеген коммерциялық қоспалары - қоспасы энантиомерлер D + және L-алма қышқылы.[7]
Сенсорлық әсер

Малолактикалық ашыту арқылы өткен шараптарда болатын сенсорлық өзгерістерге байланысты көптеген әртүрлі зерттеулер жүргізілді. Ең көп таралған дескриптор - шараптағы қышқылдық «қатал» алма қышқылының жұмсақ сүт қышқылына ауысуына байланысты «жұмсақ» сезіледі. Қабылдау қышқылдық шарап құрамындағы титрленетін қышқылдан пайда болады, сондықтан MLF-тен кейінгі ТА-ның төмендеуі шарапта қабылданған қышқылдың немесе «тартылудың» төмендеуіне әкеледі.[8]
Ауыз қуысының өзгеруі рН жоғарылауымен байланысты, бірақ сонымен қатар өндірілуіне байланысты болуы мүмкін полиолдар, әсіресе қант спирттері эритритол және глицерин.[2] Мололактикалық ашыту арқылы өткен шараптардың ауыз сезімін күшейтетін тағы бір фактор - бұл болуы этил лактаты ол MLF-ден кейін 110 мг / л дейін болуы мүмкін.[5]
Әсер етуі мүмкін шарап хош иісі күрделі және әр түрлі болжау қиын штамдар туралы Oenococcus oeni (MLF-де жиі қолданылатын бактерия) басқаша құруға мүмкіндігі бар хош иісті қосылыстар. Шардонеде MLF-тен өткен шараптар көбінесе «фундук « және »кептірілген жемістер «ноталары, сондай-ақ жаңа піскен хош иіс нан. Қызыл шараптарда кейбір штамдар амин қышқылын метаболизмге ұшыратады метионин туындысына пропион қышқылы өндіруге бейім қуырылған хош иіс және шоколад ескертулер.[2] Бөшкеде мололактикалық ашыту арқылы өтетін қызыл шараптарда дәмдеуіштер немесе түтін хош иістері күшейе алады.[3]
Алайда, кейбір зерттеулер сондай-ақ малолактикалық ашыту алғашқы жеміс хош иістерін төмендетуі мүмкін екенін көрсетті Pinot noir, жиі жоғалтады таңқурай және құлпынай MLF-тен кейінгі жазбалар.[2] Сонымен қатар, қызыл шараптар рН өзгеруіне байланысты MLF-тен кейін түс жоғалуына ұшырауы мүмкін, бұл тепе-теңдіктің өзгеруіне әкеледі антоциандар тұрақтылығына ықпал ететін шараптағы түс.[8]
Сүт қышқылы бактериялары

Шарап өндірісіне қатысатын барлық сүт қышқылы бактериялары (LAB), оң ықпал етуші ретінде немесе ықтимал ақаулардың көзі ретінде, қант көзінің метаболизмі, сондай-ақ L-алма қышқылының метаболизмі арқылы сүт қышқылын өндіруге қабілетті. Түрлер қол жетімді метаболизмге байланысты шараптағы қанттар (екеуі де) глюкоза және фруктоза, сондай-ақ ашытылмайтындар пентозалар бұл шарап ашытқылары тұтынбаңыз). Кейбір бактериялар түрлері қанттарды а арқылы пайдаланады гомоферментативті жол, бұл тек бір негізгі мағынаны білдіреді соңғы өнім (әдетте лактат) өндіріледі, ал басқалары қолданады гетероферментивті көмірқышқыл газы сияқты көптеген соңғы өнімдерді жасай алатын жолдар, этанол, және ацетат. Тек L-изомер лактат алма қышқылының конверсиясында LAB арқылы өндіріледі, гетеро- және гомоферменттер глюкозадан лактиканың D-, L- және DL-изомерлерін шығаруы мүмкін, бұл шараптағы сенсорлық қасиеттерге әсер етуі мүмкін.[3]
Әзірге O. oeni көбінесе шарап өндірушілері мололактикалық ашытуды қалайтын LAB болып табылады, бұл процесті көбінесе ашыту кезінде әр түрлі нүктелерде басым болатын LAB түрлері жүзеге асырады. Қай түрдің басым болатынына бірнеше факторлар әсер етеді, соның ішінде ашыту температурасы, қоректік ресурстар, олардың болуы күкірт диоксиді, ашытқы және басқа бактериялармен өзара әрекеттесу, рН және алкоголь деңгейлері (Лактобакиллус мысалы, түрлер рН-ны жоғарылатады және алкоголь деңгейіне қарағанда төзімді O. oeni), сондай-ақ бастапқы егу (мысалы, «жабайы» ферменттеу өсірілетін егуге қарсы) O. oeni).[4]
Оенококк

Тұқым Оенококк шарап өндірісіне қатысатын бір негізгі мүшесі бар, O. oeni, бір кездері ретінде белгілі Leuconostoc oeni. Атауы болғанына қарамастан Oenoкокк, микроскопта бактерия а бацилл (пішін) таяқша пішіні. Бактериялар - а Грам позитивті, факультативті анаэроб кейбіреулерін қолдана алады оттегі үшін аэробты тыныс алу бірақ көбінесе ферменттеу арқылы жасушалық энергия өндіреді. O. oeni бұл глюкозаны D-сүт қышқылы және көмірқышқыл газы бар этанолға немесе ацетатқа тең мөлшерде өндірілетін глюкозаны қолданудан бірнеше соңғы өнім жасайтын гетероферментер. Жылы редуктивті жағдайлар (мысалы, алкогольдік ашытудың соңы), үшінші өнім, әдетте, аздап болған кезде этанол болып табылады тотығу (мысалы, ерте алкогольдік ашыту немесе ан үстіңгі бөшке ), бактериялар ацетат түзуі ықтимал.[8]
Кейбіреулер O. oeni штамдар жасау үшін фруктозаны қолдана алады маннит (бұл маннитпен боялған шарап ақауларына әкелуі мүмкін), ал көптеген басқа штамдар оларды бұзуы мүмкін амин қышқылы аргинин (ол шарапта болуы мүмкін) лис ашығаннан кейін автолиз ашытқы жасушалары) аммиак.[2]
Сонымен қатар гексоза глюкоза және фруктоза қанттары, көбінесе штамдары O. oeni пайдалана алады пентозаның қалдықтары ашытқы ашытуынан қалған қанттар, соның ішінде L-арабиноза және рибоза. Тек шамамен 45% O. oeni штамдар ашытуы мүмкін сахароза (әдетте қант түрі қосылады шапаттылық ашытқы глюкоза мен фруктозаға айналады).[2]
Шарап өндірушілер басымдыққа ие O. oeni бірнеше себептерге байланысты. Біріншіден, түр негізгі шарап ашытқыларымен үйлеседі Saccharomyces cerevisiae дегенмен, MLF және алкогольдік ашытуды бірге бастаған жағдайларда, ашытқы көбінесе бактерияларды тағамдық ресурстарға қарсы алады, бұл малолактикалық ашудың басталуын кешіктіруі мүмкін. Екіншіден, көптеген штамдар O. oeni рН деңгейінің төмендігіне төзімді және әдетте стандартпен жұмыс істей алады алкоголь деңгейі шараптардың көпшілігі ашытудың соңында жетеді. Сонымен қатар, күкірт диоксиді 0,8 молекулалық SO-дан жоғары болса2 (рН тәуелді, бірақ шамамен 35-50 ррм) бактерияларды тежейді, O. oeni басқа LAB-мен салыстырғанда салыстырмалы төзімді. Соңында, O. oeni ең аз мөлшерін өндіруге бейім биогенді аминдер (және ең көп сүт қышқылы[3]) шарап өндірісінде кездесетін сүт қышқылы бактерияларының арасында.[8]
Лактобакиллус
Тұқым ішінде Лактобакиллус екеуі де гетероферментивті және гомоферментативті түрлер. Шарап өндірісіне қатысатын барлық лактобактериялар грам-позитивті және микроаэрофильді, көптеген түрлерде фермент жетіспейді каталаза қорғану үшін қажет тотығу стрессі.[2]
Түрлері Лактобакиллус шарап пен жүзімнен оқшауланған, бүкіл әлем бойынша сынамалар болуы керек L. brevis, L. buchneri, L. casei, L. curvatus, L. delbrueckii кіші лактис, L. diolivorans, L. fermentum, L. fructivorans, L. hilgardii, L. jensenii, L. kunkeei, L. leichmannii, L. nagelii, L. paracasei, L. plantarum, және L. yamanashiensis.[2]
Көпшілігі Лактобакиллус түрлері шарап өндірісінде жағымсыз, олар жоғары деңгейге ие ұшқыш қышқылдық, жағымсыз иістер, шарап тұман, газдық және шөгінді оны бөтелкеге салуға болады, әсіресе егер шарап болмаса сүзілген. Бұл бактериялардың шараптың хош иісі мен сенсорлық қабылдауына одан әрі әсер етуі мүмкін сүт қышқылының шамадан тыс мөлшерін түзуге мүмкіндігі бар. Кейбір түрлері, мысалы, «қатыгез Лактобакиллус«, жалқау немесе кептірілген ашыту сияқты басқа түрлер, мысалы L. fructivorans, мақта жасау белгілі болды мицелий - шараптар бетіндегі өсу сияқты, ол ашылған шарап аймағынан кейін «Фресно зеңі» деген лақап атқа ие.[8]
Педиококк

Әзірге тұқымдастың төрт түрі Педиококк шараптарда және жүзімде оқшауланған, P. inopinatus, P. pentosaceus, P. parvulus, және P. damnosus, соңғы екеуі көбінесе шарапта кездесетін түрлер. Барлық Педиококк түрлері грам-позитивті, кейбір түрлері микроэрофильді, ал басқалары көбінесе аэробты тыныс алуды қолданады. Микроскопта, Педиококк көбінесе оларды анықтауға болатын жұптарда немесе тетрадада пайда болады. Педиококктар - гофозды а-ға дейін метаболиздейтін гомоферментер рацемиялық қоспасы L- және D-лактаттың екеуі де гликолиз.[5] Алайда, глюкоза болмаған кезде кейбір түрлері, мысалы P. pentosaceus, қолдануды бастаңыз глицерин, оны төмендетеді пируват кейінірек оны диацетилге, ацетатқа, 2,3-бутандиол және шарапқа жағымсыз сипаттамалар бере алатын басқа қосылыстар.[2]
Көпшілігі Педиококк өндіруге болатын диацетилдің жоғары деңгейіне, сондай-ақ бір ықтимал себепке айналған биогенді аминдер өндірісінің жоғарылауына байланысты түрлер шарап жасауда жағымсыз. қызыл шараптың бас ауруы. Көптеген түрлері Педиококк сондай-ақ шарапқа глицериннің ыдырауынан пайда болатын ащы-дәмді «акролеин бояуы» сияқты шарапқа жағымсыз иістерді немесе басқа ақаулықтарды енгізу мүмкіндігі бар. акролин содан кейін әрекет етеді шарап құрамындағы фенолды қосылыстар ащы-дәмді қоспа шығару үшін.[8]
Бір түр, P. parvulus, MLF-тен өтпеген (шарапта алма қышқылы бар дегенді білдіреді) шараптардан табылған, бірақ әлі күнге дейін гүл шоқтарын энолог «бұзылмаған» немесе кемшіліктер деп сипаттаған түрде өзгерткен. Басқа зерттеулер оқшауланған P. parvulus жағымсыз иіс немесе шарап ақаулары пайда болмай, малолактикалық ашыту арқылы өткен шараптардан.[2]
Тамақтануға қойылатын талаптар

Сүт қышқылы бактериялары болып табылады жылдам организмдер барлық күрделі тағамдық қажеттіліктерді өздігінен синтездей алмайтын заттар. LAB өсіп, малолактикалық ашытуды аяқтауы үшін шарап ортасының конституциясы олардың тағамдық қажеттіліктерін қамтамасыз етуі керек. Шарап ашытқысы сияқты, LAB үшін де энергия алмасуы үшін көміртегі көзі қажет (әдетте қант және алма қышқылы), азот көзі (аминқышқылдары және пуриндер ) үшін ақуыз синтезі, және әр түрлі дәрумендер (мысалы ниацин, рибофлавин, және тиамин ) және ферменттер мен басқа жасушалық компоненттердің синтезіне көмектесетін минералдар.[5]
Бұл қоректік заттардың қайнар көзі көбінесе жүзімнің өзінен табылады, алайда алкогольдік ферментациямен қатар жүретін MLF инокуляциялары ашытқының осы қоректік заттарға бактериялардың әсер етуі қаупін тудырады. Ферменттеудің соңына қарай, түпнұсқа жүзімнің ресурстарының көп бөлігі жұмсалған болуы керек, ал лизис ашытқы жасушаларының жасушалары («лис») кейбір қоректік заттардың, әсіресе аминқышқылдардың көзі бола алады. Сонымен қатар, құрғақтыққа дейін ашытылған «құрғақ» шараптар әлі де бар ашытылмайтын пентозды қанттар (мысалы, арабиноза, рибоза және ксилоза ) оң және бұзылатын бактериялар қолдана алатын артта қалды. Шарап ашытқысы сияқты, өсірілген LAB инокументін өндірушілер, әдетте, қосымша ретінде қолданылатын арнайы дайындалған тағамдық қоспаларды ұсынады. Алайда, шарап ашытқысынан айырмашылығы, сүт қышқылы бактериялары қоспаны қолдана алмайды диаммоний фосфаты азот көзі ретінде[2]
Күрделі тағамдық қоспалар енгізілмес бұрын және LAB мұздатылған кептірілген дақылдарында жетістіктер пайда болғанға дейін, шарап жасаушылар сүт қышқылды бактериялардың егуін өсіретін еді мәдени көлбеу зертханалармен қамтамасыз етілген. 1960 жылдары бұл шарап жасаушылар жасауды оңайырақ деп тапты стартерлік мәдениеттер қамтылған бұқаралық ақпарат құралдарында алма немесе қызанақ шырыны. Бұл «қызанақ шырынының факторы» туындысы болып табылды пантотен қышқылы, маңызды өсу факторы бактериялар үшін.[8]
Ашытқылардағы сияқты, оттегін LAB үшін қоректік зат деп санауға болады, бірақ өте аз мөлшерде және тек микроаэрофильді түрлер үшін O. oeni. Алайда, малолактикалық ашыту аэробты жағдайда анаэробты жағдайларға қарағанда анағұрлым тегіс жүреді деген нақты дәлелдер жоқ, ал іс жүзінде оттегінің көп мөлшері бәсекелес микробтардың жағдайын жақсарту арқылы LAB өсуін тежей алады (мысалы). Ацетобактерия).[8]
Жүзімдіктер мен шарап зауыттарындағы жергілікті LAB түрлері

Oenococcus oeni, шарап жасаушылар көбінесе малолактикалық ашытуды қалайтын LAB түрлерін жүзім алқабында, бірақ көбінесе өте төмен деңгейде табуға болады. Зеңді, зақымдалған жемістер микробтардың алуан флорасын алып жүру мүмкіндігіне ие, LAB көбінесе таза, сау жүзімде кездеседі егін түрлері Лактобакиллус және Педиококк тұқымдас. Ұсақтағаннан кейін микробиологтар әдетте 10 жасқа дейінгі популяцияларды табады3 колонияны құрайтын бөлімдер / мл қоспасы бар P. damnosus, L. casei, L. hilgardii, және L. plantarum, Сонымен қатар O. oeni. Күкірт диоксидінің ерте дозасын ала алмайтын мусс үшін LAB-дің жабайы популяциясын «кері қайтару» үшін бактериялардың бұл флорасы ашытудың басында қоректік заттар үшін бір-бірімен (және шарап ашытқыларымен) бәсекелеседі.[8]
Шарап зауытында бірнеше байланыс пункттері LAB-дың жергілікті тұрғындары бола алады, соның ішінде емен бөшкелері, сорғылар, шлангілер және құю желілері. Малолактикалық ашыту қажет емес шараптар үшін (мысалы, жемісті ақ шараптар) санитарлық тазалық шарап жабдықтары қажетсіз MLF дамуына әкелуі мүмкін және нәтижесінде шарап ақаулары. Толық және толық санитарлық тазалау мүмкін емес емен бөшкелерінде, шарап зауыттары көбінесе құрамында MLF арқылы өтетін шараптары бар бөшкелерді белгілеп, оларды «таза» немесе оқшауланбаған шараптар үшін қолдануға болатын жаңа бөшкелерден оқшаулайды. MLF.[4]
Шизосахаромицеттер ашытқы
Тұқымдастардың бірнеше түрлері Шизосахаромицеттер л-алма қышқылын қолданыңыз, ал энологтар бұл шарап ашытқысын бактериямен дәстүрлі малолактикалық ашыту жолының орнына шараптарды қышқылсыздандыру үшін қолданудың әлеуетін зерттеді. Алайда, ерте нәтижелер Шизосахаромицес помбы ашытқының шараптағы иістер мен жағымсыз сенсорлық сипаттамаларды шығаруға бейімділігін көрсетті. Соңғы жылдары энологтар эксперимент жүргізіп жатыр мутант штамм Шизосахаромиттер малидеворандары шараптың кемшіліктері мен иістерінен аз шығатыны осы уақытқа дейін көрсетілген.[2]
Егу уақытының әсері

Шарап өндірушілер LAB-мен егуді таңдаған кезде ерекшеленеді, кейбір шарап өндірушілер бактерияларды ашытқымен бір уақытта қосып, алкогольдік және малолактикалық ашытудың қатар жүруіне мүмкіндік береді, ал кейбіреулері шарап болған кезде ашыту аяқталғанша күтеді. тірелген оның тесігінен және баррельге, ал басқалары мұны бір жерде жасайды. Минимализмнің немесе «табиғи шарап жасау «өсірілген LAB-мен екпеуді қалайтындар, мололактикалық ашыту шарап зауытының микробиологиялық флорасы және осы басқа микробтардың бәсекелес әсері сияқты бірнеше факторларға байланысты кез-келген уақытта болуы мүмкін. Барлық нұсқалардың пайдасы мен кемшіліктері бар.[5]
Алкогольдік ашыту кезінде MLF егудің артықшылықтары:[2]
- Жүзімнен көбірек потенциалды қоректік заттар қажет (бірақ бактериялар олар үшін ашытқымен бәсекелес болады)
- Күкірт диоксиді мен этанол деңгейінің төмендеуі, олар LAB-ны басқаша тежей алады
- LAB өсуіне және MLF-ті ертерек аяқтауға қолайлы ферменттеудің жоғары температуралары: Малолактикалық ашыту үшін оңтайлы температура 20 мен 37 ° C (68 және 98,6 ° F) аралығында болады, ал бұл процесс 15 ° C-тан төмен температурада айтарлықтай тежеледі. (59 ° F). Ашытудан кейінгі қыс мезгілінде жертөлелердегі бөшкелерде сақталған шарап салқын жертөле температурасына байланысты малолактикалық ашытуды ұзаққа созады.
- Малолактикалық ашытуды мерзімінен бұрын аяқтау шарап жасаушыдан кейінгі SO-ны жасай алады дегенді білдіреді2 шарапты қорғау үшін ертерек тотығу және бұзылатын микробтар (мысалы Ацетобактерия ). Күкірт диоксиді MLF-ті тежей алатындықтан, LAB егілуін алкогольдік ашытуға дейін кешіктіру жертөле температурасы MLF аяқталуын ынталандыру үшін жеткілікті қызған кезде күкірт қосудың кешігуін білдіруі мүмкін.
- Диацетил өндірісі аз[3]
Ерте егудің кемшіліктеріне мыналар жатады:[2]
- Шарап ашытқысы және LAB микробтар арасындағы ресурстарға (глюкозаны қоса) және әлеуетті антагонизмге бәсекелес
- Сияқты гетероферментер O. oeni қажеттіліктегі глюкозаны метаболиздеу және сірке қышқылы сияқты жағымсыз жанама өнімдерді жасау
Посткогольдік ашытудың көптеген артықшылықтары ерте егудің кемшіліктеріне жауап береді (атап айтқанда антагонизм және жағымсыз жанама өнімдердің әлеуеті). Сондай-ақ, артықшылығы лис арқылы қоректік заттардың көзі бола алады автолиз ашытқы клеткаларының, бірақ қоректік заттар көзі MLF аяқталғанға дейін сәтті өтуін қамтамасыз ету үшін әрдайым жеткіліксіз болуы мүмкін. Керісінше, кеш егудің көптеген кемшіліктері ерте егуден болатын артықшылықтардың болмауы (жоғары температура, тез аяқталуы және т.б.).[5]
MLF алдын алу

Шараптың кейбір стильдері үшін, мысалы, жеңіл, жемісті шараптар немесе жылы климаттағы аз қышқылды шараптар үшін малолактикалық ашыту қажет емес. Шарап өндірушілер MLF өтуіне жол бермеу үшін бірнеше қадамдар жасай алады, оның ішінде:[4][9]
- Шектелген мацерация, ерте басу және ерте сөре потенциалды қоректік көздермен LAB байланысының уақытын шектеу
- Күкірт диоксиді деңгейін кем дегенде 25 ppm «бос» (байланыссыз) SO деңгейінде ұстаңыз2, шараптың рН-на байланысты, бұл 50-100 мг / л SO қосылуын білдіруі мүмкін2
- РН деңгейін 3.3-тен төмен деңгейде ұстаңыз
- Шарапты 10 мен 14 ° C (50. 0 - 57.2 ° F) температурада салқындатыңыз.
- Шарапты бөтелкеге құю кезінде 0,45- тен кем емес сүзгіден өткізіңізмикрон бактериялардың бөтелкеге енуіне жол бермейтін мембраналық сүзгі
Сонымен қатар, шарап өндірушілер химиялық және биологиялық ингибиторларды қолдана алады лизоцим, нисин, диметил дикарбонат (Велкорин), және фумар қышқылы дегенмен, кейбіреулері (Верлкорин сияқты) Құрама Штаттардан тыс шарап жасайтын елдерде шектелген. Сияқты айыппұл салатын агенттер бентонит және шарапты қою арқылы суық тұрақтандыру сонымен қатар LAB үшін потенциалды қоректік заттарды алып тастайды, осылайша малолактикалық ашытуды тежейді. Пайдалану арқылы кейбір эксперименттер бактериофагтар (вирустар малолактикалық ашытуды шектеу үшін жүргізілген, бірақ ірімшік жасау саласындағы көңіл көншітпейтін нәтижелер шарап жасауда бактериофагтарды іс жүзінде қолдануға күмән туғызды.[8]
Зиянды мазмұнды өлшеу

Шарап жасаушылар малолактические ферментацияның дамуын бақылай алады қағаз хроматография немесе а спектрофотометр. Қағаз хроматография әдісі шараптың кішкене үлгілерін хроматограф қағазына қосу үшін капиллярлық түтіктерді қолдануды қамтиды. Содан кейін қағаз оралып, а толтырылған құмыраға салынады бутанол құрамында ерітінді бромокресол жасыл бірнеше сағат бойы индикаторлы бояғыш. Қағазды шығарып, кептіргеннен кейін, сары түсті «дақтардың» негізгі сызықтан қашықтығы әр түрлі қышқылдардың болуын білдіреді, ал шараптар негізге ең жақын, содан кейін лимон, алма және ақырында сүт қышқылдары қағаз.[4]
Қағаздағы хроматографияның едәуір шектеулері - бұл шарапта қанша алмаиннің қалатындығын дәл көрсетпейтіндігінде, бұл қағаздағы «сплотч» мөлшерінің сандық көрсеткішпен ешқандай байланысы жоқ. Қағаздың сезімталдығы 100-200 мг / л анықтау шегімен шектелген, ал «MLF тұрақтылығының» көптеген өлшемдері 0,03 г / л-ден (30 мг / л) төмен алмацевтік деңгейге бағытталған.[5]
Ферментативті әдіс алма және сүт қышқылдарының мөлшерін өлшеуге мүмкіндік береді, бірақ реактивтер жиынтығы мен өлшей алатын спектрофотометрдің шығынын қажет етеді сіңіру 334, 340 немесе 365 мәндері нм.[5]
Өндірілген басқа өнімдер
Малолактикалық ашытудың негізгі өнімдері - сүт қышқылы, диацетил, сірке қышқылы, ацетоин және әр түрлі күрделі эфирлер. Бұл өнімнің мөлшері мен нақты сипаты малолактикалық ашытуды жүргізетін LAB түріне / штамына және шарапқа әсер ететін жағдайға (рН, қол жетімді қоректік заттар, оттегінің деңгейі және т.б.) байланысты.[3]
Кейбір штамдары O. oeni синтездей алады жоғары спирттер бұл шарап хош иісті жеміс ноталарына ықпал ете алады. Сонымен қатар, бактериялардың кейбір штамдары бар бета-глюкозидаза ыдырауы мүмкін ферменттер моноглюкозидтер бұл қант молекуласына бекітілген хош иісті қосылыстар. Қант компоненті бөлінген кезде, қосылыстың қалған бөлігі айналады өзгермелі, мүмкін, бұл мүмкін анықталуы керек шараптың хош иісі шоғырында.[2]
21 ғасырдың басында кейбір штамдары O. oeni қолдануға болатындығы көрсетілді ацетальдегид оны этанолға немесе сірке қышқылына ыдыратады. Бұл ацетальдегидтің мөлшері жоғары шараптарға, ал қызыл шараптарға әсер етуі мүмкін, сонымен қатар ацетальдегидтің реакциясына араласып, шарап түсін тұрақсыздандыруы мүмкін. антоциандар құру полимерлік пигменттер бұл шараптың түсін жасауға көмектеседі.[2]
Диацетил

Диацетил (немесе 2,3-бутанедион) - бұл Шардоннайдың «май» хош иістерімен байланысты қосылыс, бірақ ол малолактикалық ашыту арқылы өткен кез-келген шарапқа әсер етуі мүмкін. Ан иісті анықтау шегі ақ шараптарда 0,2 мг / л және қызыл шараптарда 2,8 мг / л болса, оны 5-тен 7 мг / л-ге дейін (5-7) жоғары концентрацияларда аздап май немесе «жаңғақ» деп қабылдауға болады. бет / мин ) басқаларын басып озуы мүмкін хош иісті ноталар шарапта.[7][10]
Диацетилді LAB қант немесе метаболизмі арқылы өндіре алады лимон қышқылы.[11] Лимон қышқылы жүзімде табиғи түрде болғанымен, оның мөлшері өте аз, көбісі шарап өндірушісінің шарапты қышқылдандыру үшін қасақана қосқандығынан болады.[8] Алма және лимон қышқылдарының қатысуымен LAB екеуін де пайдаланады, бірақ маликті әлдеқайда тез пайдаланады, лимон қолдану жылдамдығы / диацетил түзілуімен белгілі бір бактериялық штамдар әсер етеді (штаммдарының көпшілігімен O. oeni диацетилді аз шығарады Лактобакиллус және Педиококк түрлері), сонымен қатар тотықсыздандырғыш шараптың әлеуеті.[12] Төмен тотығу-тотықсыздану потенциалы бар шарап жағдайында (ол толығымен толтырылмаған бөшкедегідей тотықтырғышты білдіреді), көбірек лимон қышқылы жұмсалады және диацетил түзіледі. Ашытқылардың популяциясы ең жоғары деңгейге жеткен және шарап көмірқышқыл газымен қатты қаныққан алкогольдік ашыту кезінде, редуктивті жағдайда диацетилдің түзілуі әлдеқайда баяу жүреді. Ашытқылар диацетилді тұтыну және оны ацетоинге дейін төмендету арқылы деңгейдің төмендеуіне көмектеседі бутиленгликоль.[5]
Диацетил өндірісі 18 ° C (64,4 ° F) және 25 ° C (77 ° F) температура кезінде жылы болатын ашыту кезінде қолайлы. Сондай-ақ, ол рН деңгейі төмен шараптарда (3,5-тен төмен) жоғары деңгейде өндірілуге ұмтылады, бірақ 3.2-ден төмен болса, MLF үшін қолайлы LAB штамдарының көпшілігі тежелуге бейім. «Жабайы» (егілмеген сияқты) малолактикалық ферменттер егілген ферментке қарағанда көбірек диацетил өндіре алады кешігу фазасы әдетте 10 инокуляцияға ие егілген ферменттермен6 CFU / мл.[2] Кеш MLF инокуляциялары алкогольдік ашытудан кейін де диацетилдің жоғары деңгейлерін шығаруға бейім.[3] Шардоннай өндірушілері жоғары диацетилді «сары май стилін» жасағысы келеді, көбіне шараптың бірнеше апта, тіпті бірнеше ай жұмсауына мүмкіндік беріп, алғашқы ашығаннан кейін баррельге кеш немесе «жабайы» егеді. өтірік диацетил өндірісіне ықпал ететін редуктивті жағдайда.[8] Кейбір дереккөздерде диацетилдің тірі қалған диацетил метаболизденуіне байланысты ашытқының арқасында өтірік азаяды, сондықтан малолактические ферментация жақсы жүреді.[13]
Диасетилдің шамадан тыс мөлшері бар шараптарда кейбір шарап өндірушілер қосылыспен байланысып, диацетилді қабылдауды 30-дан 60% -ға дейін төмендету үшін күкірт диоксидін пайдаланады. Бұл байланысу қайтымды процесс болып табылады және тек бірнеше аптадан кейін қартаю бөтелкеде немесе бакта диацетилдің жоғары деңгейі қайтарылады. Алайда, малолактикалық ашыту процесінде ертерек қосылған күкірт диоксиді бактерияларды тежеп, олардың белсенділігін толығымен шектеу арқылы диацетил өндірісін шектейді, соның ішінде алма сүт қышқылына айналады.[7]
Шарап ақаулары

Малолактикалық ашытуға байланысты ең көп таралған ақаулық - бұл оның қаламаған кезінде пайда болуы. Бұл қышқыл және жемісті болуы керек шарап үшін болуы мүмкін (мысалы, Рислинг) немесе ол бұрын MLF арқылы өтіп, бөтелкеде мололактикалық ашыту басталуы үшін ғана құйылған шарап болуы мүмкін. Бұл «бөтелкедегі» ашытудың нәтижесі көбінесе газды, тұманды шарап болып табылады, ол тұтынушыларға жағымсыз болуы мүмкін. Санитарлық жағдайды жақсарту және шарап зауытындағы сүт қышқылы бактерияларын бақылау бұл ақаулардың пайда болуын шектеуі мүмкін.[7]
Винхо-Верденің алғашқы өндірушілері үшін бөтелкедегі малолактикалық ашыту нәтижесінде пайда болған шамалы көпіршіктер тұтынушыларға шарапты ұнататын айрықша қасиет деп саналды. Алайда, шарап шығаратын зауыттар «бөтелкедегі MLF» шығарған ластануды және шөгінділерді жасыру үшін мөлдір емес бөтелкелердегі шарапты сатуға мәжбүр болды. Бүгінгі таңда Vinho Verde өндірушілерінің көпшілігі бұл тәжірибені қолданбайды, оның орнына жасанды карбонаттау арқылы аздап жарқырап, бөтелкеге дейін малолактикалық ашытуды аяқтайды.[8]
Молаксикалық ашыту міндетті түрде ақаулық болмаса да, рН өзгеруіне байланысты шарапты «ақуызды тұрақсыз» ете алады, бұл ерігіштігіне әсер етеді. шараптағы ақуыздар. For this reason, protein fining and heat stability tests on wine usually take place after malolactic fermentation has run to completion.[5]
Ұшқыш қышқылдық
Әзірге ұшқыш қышқылдық (VA) is usually measured in terms of acetic acid content, its sensory perception is a combination of acetic (vinegary aromas) and этил ацетаты (лак кетіргіш және ұшақ моделі желім aromas). High levels of VA can inhibit wine yeast and may lead to a sluggish or stuck fermentation. Several microbes can be a source for VA, including Ацетобактерия, Brettanomyces, және film yeast сияқты Candida, as well as LAB. However, while LAB usually only produce acetic acid, these other microbes often produce ethyl acetate, as well as acetic acid.[7]
Most wine-producing countries have laws regulating the amount volatile acidity permitted for wine available for sale and consumption. Ішінде АҚШ, the legal limit is 0.9 g/l for foreign wine exported to the United States, 1.2 g/l for white table wine, 1.4 g/l for red wine, 1.5 g/l for white десерт шарабы, and 1.7 g/l for red dessert wine. Еуропалық Одақтың шарап ережелері limit VA to 1.08 g/l for white table wines and 1.20 g/l for red table wines.[2]
Heterofermenting species of Оенококк және Лактобакиллус have the potential to produce high levels of acetic acid through the metabolism of glucose, though with most strains of O. oeni, the amount is usually only 0.1 to 0.2 g/l.[5][14] Бірнеше түрлері Педиококк can also produce acetic acid through other pathways. Wines starting out with a high pH levels (above 3.5) stand the greatest risk of excessive acetic acid production due to the more favorable conditions for Лактобакиллус және Педиококк түрлері.[7][15] L. Kunkeei, one of the so-called "ferocious Лактобакиллус" species, has been known to produce 3 to 5 g/l of acetic acid in wines—levels which can easily lead to stuck fermentations.[2]
«Айуандық» Лактобакиллус
In the late 20th century, among American winemakers, seemingly healthy fermentation were reported becoming rapidly inundated with high levels of acetic acid that overcame wine yeasts and led to stuck fermentations. While a novel species of Ацетобактерия or wine spoilage yeast was initially thought to be the culprit, it was eventually discovered to be several species of Лактобакиллус, L. kunkeei, L. nagelii, және L. hilgardii, collectively nicknamed "ferocious" Лактобакиллус for their aggressive acetic acid production, how quickly they multiply, and their high tolerance to sulfur dioxides and other microbiological controls.[8]
Ferments of high-pH wines (greater than 3.5) that spent time cold soaking prior to yeast inoculations and received little to no sulfur dioxide during ұсақтау seem to be at the most risk for "ferocious" Лактобакиллус. While infection seems to be vineyard-specific, currently, none of any of the implicated lactobacilli has been reported as being found on the surface of freshly жиналды wine grapes.[8]
Acrolein and mannitol taint

The degradation of glycerol by some strains of LAB can yield the compound акролин. Glycerol is a sweet-tasting полиол present in all wines, but at higher levels in wines that have been infected with Botrytis cinerea. An "active-альдегид ", acrolein can interact with some phenolic compounds in wine to create highly bitter-tasting wines, described as amertume by Pasteur. While at least one strain of O. oeni has been shown to produce acrolein, it is more commonly found in wines that have been infected by strains of Лактобакиллус және Педиококк сияқты түрлері L. brevis, L. buchneri, және P. parvulus. Acrolein taint has also shown to be more common in wines that have been fermented at high temperatures and/or made from grapes that have been harvested at high Brix деңгейлер.[2]
Heterofermenting species from the genus Лактобакиллус, as well as some wild strains of O. oeni, have the potential to metabolize fructose (one of the main sugars in wine) into the sugar alcohols маннит and (less commonly) эритритол. These are sweet-tasting compounds can add sweetness to a wine where it is not desired (such as Cabernet Sauvignon ). Mannitol taint, described as mannite by Pasteur, in wines is often accompanied by other wine faults, including the presence of excessive levels of acetic acid, diacetyl, lactic acid, and 2-бутанол, which can contribute to a "vinegary-estery " aroma. The wine may also have a slimy sheen on the surface.[5]
Fresno mold and ropiness
In the mid-20th century, a cottony мицелий -like growth began appearing in the bottles of some sweet нығайтылған шараптар жылы шығарылған Калифорния Келіңіздер Орталық аңғар. Being fortified, these wines often had alcohol levels in excess of 20% which is usually a level that discourages growth of most spoilage organisms associated with winemaking. Nicknamed "Fresno mold" due to where it was first discovered, the culprit of this growth was determined to be L. fructivorans, a species which can be controlled by sanitation and maintaining adequate sulfur dioxide levels.[2]
Кейбіреулер Лактобакиллус және Педиококк species (particularly P. damnosus және P. pentosaceus) have the potential to synthesize полисахаридтер that add an oily тұтқырлық шарапқа. Жағдайда Лактобакиллус, some of these saccharides may be глюкандар that can be synthesized from glucose present in the wine as low as 50–100 mg/l (0.005 to 0.01% residual sugar) and afflict seemingly "dry" wines. While "ropiness" can occur in the barrel or tank, it is often observed in the wines several months after they are bottled. Wines with pH levels above 3.5 and low sulfur dioxide levels are at most risk for developing this fault.[8]
Қоңырау шалды graisse (or "grease") by the French[7] және les vins filant by Pasteur, this fault has been observed in apple wines және сидр. It can also be potentially be caused by other spoilage microbes such as Streptococcus mucilaginous, Candida krusei, және Acetobacter rancens.[8]
Mousiness and geranium taint
Wines infected with L. brevis, L. hilgardii, және L. fermentum have been known to occasionally develop an aroma reminiscent of rodent қоқыс. The aroma becomes more pronounced when the wine is rubbed between the fingers and, if consumed, can leave a long, unpleasant аяқтау. The aroma can be very potent, detectable at a sensory threshold as low as 1.6 parts per billion (мкг /l). The exact compound behind this is туындылар of the amino acid лизин created through an oxidation reaction with ethanol.[7] While undesirable LAB species have been most commonly associated with this fault, wine infected by Brettanomyces yeast in the presence of аммоний фосфаты and lysine have also been known to exhibit this fault.[2]
Сорбат is often used as a yeast-inhibitor by home winemakers to stop alcoholic fermentation in the production of sweet wines. Most species of lactic acid bacteria can synthesize sorbate to produce 2-ethoxyhexa-3,5-diene which has the aroma of crushed герань жапырақтары.[7]
Tourne
Compared to malic and citric acids, tartaric acid is usually considered microbiologically stable. However, some species of Лактобакиллус (әсіресе L. brevis және L. plantarum) have the potential to degrade tartaric acid in wine, reducing a wine's total acidity by 3-50%. French winemakers had long observed this phenomenon and called it tourne (meaning "turn to brown")[7] in reference to the color change that can occur in the wine at the same time likely due to other processes at work in addition to the tartaric loss. Әзірге Лактобакиллус is the most common culprit of tourne, some species of the spoilage film yeast Candida can also metabolize tartaric acid.[2]
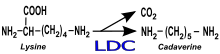
While the presence of этил карбамат is not a sensory wine fault, the compound is a suspected канцероген which is subjected to regulation in many countries. The compound is produced from the degradation of the amino acid аргинин which is present in both grape must and released in the wine through the autolysis of dead yeast cells. While the use of мочевина көзі ретінде ашытқы сіңірілетін азот (no longer legal in most countries) was the most common cause of ethyl carbamate in wine, both O. oeni және L. buchneri have been known to produce карбамилфосфат және цитруллин болуы мүмкін прекурсорлар to ethyl carbamate formation. L. hilgardii, one of the "ferocious Лактобакиллус" species, has also been suspected of contributing to ethyl carbamate production. In the United States, the Алкоголь және темекіге салық және сауда бюросы has established a voluntary target limit of ethyl carbamate in wine to less than 15 μg/l for table wines and less than 60 μg/l for dessert wines.[2]
Biogenic amines have been implicated as a potential cause of red wine headaches. In wine, гистамин, кадаверин, phenylethylamine, путресцин, және тирамин have all been detected. These amines are created by the degradation of amino acids found in grape must and left over from the breakdown of dead yeast cells after fermentation. Most LAB have the potential to create biogenic amines, even some strains of O. oeni, but high levels of biogenic amines are most often associated with species from the Лактобакиллус және Педиококк тұқымдас. Ішінде Еуропа Одағы, the concentration of biogenic amines in wine is beginning to be monitored, while the United States currently does not have any regulations.[7]
Әдебиеттер тізімі
- ^ Том Манселл "Buttery bacteria: Malolactic fermentation and you Мұрағатталды 2016-04-06 Wayback Machine " Palate Press. 10 қараша 2009 ж
- ^ а б c г. e f ж сағ мен j к л м n o б q р с t сен v w х ж К.Фугельсанг, C. Эдвардс Шарап микробиологиясы Second Edition pgs 29-44, 88-91, 130-135, 168-179 Springer Science and Business Media, New York (2010) ISBN 0387333495
- ^ а б c г. e f ж сағ Jean Jacobson "Introduction to Wine Laboratory Practices and Procedures" pgs 188-191, Springer Science and Business Media, New York (2010) ISBN 978-1-4419-3732-2
- ^ а б c г. e Доктор Яир Маргалит, Шарапхана технологиясы және операциялары Шағын шарап өндірісіне арналған анықтамалық pgs 75-78, 103 & 183-184 The Wine Appreciation Guild (1996) ISBN 0-932664-66-0
- ^ а б c г. e f ж сағ мен j к л м B. Zoecklein, K. Fugelsang, B. Gump, F. Nury Wine Analysis and Production pgs 160-165, 292-302 & 434-447 Kluwer Academic Publishers, New York (1999) ISBN 0834217015
- ^ а б c г. e f Дж. Робинсон (ред.) «Оксфордтың шарапқа серігі» Third Edition pgs 422 & 508 Oxford University Press 2006 ISBN 0-19-860990-6
- ^ а б c г. e f ж сағ мен j к л John Hudelson "Wine Faults-Causes, Effects, Cures" pgs 46-53, The Wine Appreciation Guild (2011) ISBN 9781934259634
- ^ а б c г. e f ж сағ мен j к л м n o б q р с Р.Бултон, В. Синглтон, Л.Биссон, Р. Кунки Principles and Practices of Winemaking pgs 244-273 & 369-374 Springer 1996 New York ISBN 978-1-4419-5190-8
- ^ а б c г. Sibylle Krieger "The History of Malolactic Bacteria in Wine Мұрағатталды 2012-09-15 сағ Wayback Machine pgs 15-21. Accessed: 14 May 2013
- ^ Martineau, B., Acree, T.E. and Henick-Kling, T "Effect of wine type on the detection threshold for diacetyl " Food Research International. Volume 28, Issue 2, 1995, Pages 139–143
- ^ Shimazu, Y., Uehara, M., and Watanbe, M. "Transformation of Citric Acid to Acetic Acid, Acetoin and Diacetyl by Wine Making Lactic Acid Bacteria " Agricultural and Biological Chemistry 49(7), 2147-2157, 1985
- ^ Jan Clair Nielsen and Marianne Richelieu "Control of Flavor Development in Wine during and after Malolactic Fermentation by Oenococcus oeni " Applied and Environmental Microbiology. February 1999 vol. 65 жоқ. 2 740-745
- ^ Rotter, Ben. "Sur lie and bâtonnage (lees contact and stirring) ". Improved winemaking, 2008. Retrieved 12-Feb-2016.
- ^ Krieger, S., Triolo, G., and Dulau, L. "Bacteria and Wine Quality " Lallemand. (2000) Accessed: 14 May 2013
- ^ Wibowo, D., Eschenbruch, R., Davis, C.R., Fleet, G.H., and Lee, T.H. "Occurrence and Growth of Lactic Acid Bacteria in Wine " American Journal for Enology and Viticulture. Vol. 36 No. 4 302-313 (1985)
External links
- Purdue University - "The Joy of Malolactic Fermentation " Accessed 27 Dec. 2007
- Vintessential Articles for Winemakers - Successful Malolactic Fermentations
