Zingibain - Zingibain
| Zingibain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
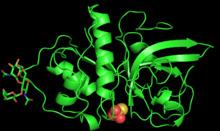 PYMOL zingibain мономерінің 3D құрылымын жасады | |||||||||
| Идентификаторлар | |||||||||
| EC нөмірі | 3.4.22.67 | ||||||||
| CAS нөмірі | 246044-91-7 | ||||||||
| Мәліметтер базасы | |||||||||
| IntEnz | IntEnz көрінісі | ||||||||
| БРЕНДА | BRENDA жазбасы | ||||||||
| ExPASy | NiceZyme көрінісі | ||||||||
| KEGG | KEGG кірісі | ||||||||
| MetaCyc | метаболизм жолы | ||||||||
| PRIAM | профиль | ||||||||
| PDB құрылымдар | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Zingibain, zingipain, немесе зімбір протеазы (EC 3.4.22.67 ) Бұл цистеин протеазы фермент табылды зімбір (Zingiber officinale ) тамырсабақтар.[1][2][3] Ол катализдер жеңілдік бөлу туралы пептидтер а пролин қалдық P2 күйінде. Оның екі ерекшелігі бар нысандары, зімбір протеазы I (GP-I) және зімбір протеазы II (GP-II).[4]
Цистеин протеаздарының папаинді тұқымдасының мүшесі ретінде цингебин бірнеше жақсы зерттелген ферменттермен құрылымдық және функционалдық ұқсастықтармен бөліседі. папаин, бромель, және актинидин. Бұл пептидазалардың құрамында центрлерінде пептидтік байланыстардың гидролитикалық бөлінуін катализдейтін белсенді цистеин қалдықтары бар. Zingibain а ретінде белсенділігімен ерекшеленеді протеиназа және а коллагеназа.[1]
Ол алғаш рет оқшауланған, тазартылған және 1973 жылы Ичикава және т.б. кезінде Жапон қыздар университеті.[5] Жақында цингабин екі болып өмір сүретіні анықталды изозимдер, Молекулалық массалары шамамен 22,500 Да болатын хроматография әдісімен оқшауланған GP-I және GP-II.[5]
Механизм
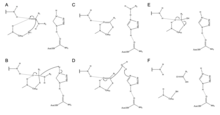
Пингидтік байланыстарды гидролитикалық жолмен бөліп алу үшін Цингабин өзінің белсенді учаскесінде Cys, His және Asn қалдықтарының каталитикалық үштігін пайдаланады. Asn175 болуы тұрақтандырады имидазол Оның сақинасы, оның гидролизді катализдеу үшін оңтайлы орналасуын қамтамасыз етеді.
Механизм протонды Cys25-тен His159-ге ауыстырудан басталады.[6] Содан кейін сульфидті анион аминқышқылына шабуыл жасайды альфа көміртегі, ауыстыру амин тобы 159.[6] Содан кейін тұрақталған амин қышқылындағы альфа көміртегіне су молекуласы шабуыл жасайды, ол аминқышқылын а-ға айналдыру үшін Cys25 сульфидін ығыстырады. карбон қышқылы, ол белсенді ферменттерден бөлінеді.[6]
Эксперименттік енгізу дититрейтол, белгілі тиол тобы протектор, орталық цистеин қалдықтарының ферментативті белсенділікке маңыздылығын әрі қарай тексеруді қамтамасыз ететін протеолитикалық белсенділікті жақсартады.[7]
Zingibain айналымның максималды жылдамдығын 60 ° C-та көрсетеді және тез денатурацияны 70 ° C-де көрсетеді.[8] Зімбірмен пісіру кезінде протеолиз негізінен кедергісіз болады. Папаин мен фициннің оңтайлы температуралық диапазоны цинибайнға қарағанда жоғарылайды, ал бромелайн сәл төмен диапазонда жұмыс істейді.[7]
Зинибаиннің максималды протеолитикалық белсенділігі рН 6,0-де болады, дегенмен фермент рН 4,5-тен 6,0-ге дейін белсенді болады (оңтайлы рН үшін ет маринадтары ).[7]
GP-II, екі изозиманың қышқылдығы көп, а pI 4.82 және GP-I 5.05 немесе 5.16-да pI мәндерін көрсетеді.[1] Бұл pI бірнеше мәні GP-I екі ақуыздың қоспасы болуы мүмкін деген теорияны қолдайды.
Құрылым
Зингибайнды алғаш рет 2000 жылы зерттеушілер рентгендік кристаллографиямен тазартты және сипаттады Бостон университеті.[1]
Ферменттің ұзындығы 221 амин қышқылы және 2-мен гликозилденген N байланысқан олигосахарид Asn96 және Asn154 тізбектері.[3] Зинибаиннің полипептидтік тізбегі орталық бейтарап саңылауға бөлінген, шамамен бірдей мөлшердегі екі полярлық доменге жиналады.[3] Бірінші доменде бар альфа спиралдары, ал екіншісі бар антипараллель бета парақтары.[3] Полярлық және полярлық емес аймақтарды осылай бөлу фермент пен субстраттардың үлкен ауқымы арасындағы ақуыз-ақуыздың өзара әрекеттесуін жеңілдетеді.[3]
Орталық саңылауда орналасқан цингабиннің белсенді орны тереңдігі 5,5 and және ұзындығы 9,5 .5.[3] Белсенді учаскеде Cys25, His159 және Asn175 каталитикалық үштігі бар, олар қышқыл / негіз катализін бірлесіп қолдайды.
Zingibain P2 позициясында пролині бар пептидті субстраттармен байланыстыру ерекшелігін көрсетеді.[1] Zingibain S2 қосалқы торабында Trp67-Met68-Asn69-Thr133-Ala157 аминқышқылдарының тізбегі бар, бұл папаиндер тұқымдасының басқа ферменттері ұнататын гидрофобты хош иісті субстраттың қалдықтарын орналастыру үшін алаңды тым ықшам етеді.[1] Алайда, пролин осы аймақпен бірнеше ковалентті емес өзара әрекеттесу арқылы тұрақтанады.
Фермент құрылымы тұрақтандырылған сутектік байланыстар, Сонымен қатар өзара байланыстыру цистеин қалдықтарының үш жұбы (Cys22-Cys63, Cys56-Cys95 және Cys153-Cys200) арасындағы сульфидті байланыстар, көптеген басқа папаиналарға ұқсас.[1]
Фермент ерітіндіде мономер ретінде болса, кристалданған цинибаин түзіледі тетрамерлер немесе әр суббірлікте гликозилдену тізбектерімен байланысқан димерлердің димерлері. Zingibain екі қалдықта күрделі типті N байланыстырылған олигосахарид тізбектерін көрсетеді.[1] Тізбектердің ұзындығы 5-13 гликозил бірлігі арасында болады N-ацетилглюкозамин, фукоза, маноз, және ксилоза. Zingibain қант тізбегі лектиндерде кездесетін олигосахаридтермен бірдей Жапондық пагода ағашы тұқымдар, laccase а бастап шынар жасушалар, және S-гликопротеидтер Brassica campestris.[1]
Биологиялық маңызы
Зімбір тамырларының ішінде зімбір протеазы оны күтіп-ұстау үшін көптеген функционалды рөлдерге қатысады өсімдік жасушалары.
Цингеин, көптеген цистеин протеаздары сияқты, 40-50 кДа ретінде синтезделеді протеин цитоплазмалық полисомалар байланысты жасушалық мембраналар.[9] Ішінде эндоплазмалық тор, бұл созылған тізбектер а KDEL ER сақтау сигналы және үлкен KDEL-ге орналастырылған көпіршіктер ER-ден ақуызды сақтауға ауысады вакуольдер жылы жасуша қабырғалары.[9]
Zingibain ақуызды сақтауға қатысады (ішінде тұқымдар немесе өсімдік тіні ), бірақ көбінесе сақтау белоктарын ыдыратады және жұмылдырады. Ол сондай-ақ жауап бере алады абиотикалық және биотикалық сияқты стресс жылу соққысы, суық температура және дегидратация, нәтижесінде пайда болған қате немесе жою денатуратталған белоктар.[9]
Қолданады
Ет жұмсартқыш
Ұнайды папаин бастап папайялар және бромель бастап ананас, ол а ретінде қолданылады ет жұмсартқыш.[10][11]
Етті, әдетте, шикі немесе кептірілген зімбірдің құрамына қосқанда, цингабин еттің нәзіктігін жоғарылатады.[8][12] Еттің нәзіктенуі, әсіресе, бұлшық ет белоктарының цингибаиннің тез протеолизіне байланысты болады актомиозин және I типті коллаген, табылған бұлшықет буындары.[8]
Папаин, фицин және бромелейнді қосқанда, басқа папаин ферменттері көбінесе етті жұмсақтау үшін қолданылады, ал цинибайн протеолитикалық белсенділіктің ұқсас немесе жоғарылауын көрсетеді.[11] Шын мәнінде, цингабин - коллагенолитикалық белсенділігі бар жалғыз каталогталған өсімдік протеазы. Алынған еттің құрылымына байланысты цингабин папаинге қарағанда жақсырақ ет жұмсартқыш болуы мүмкін. Папаин актомиозинді гидролиздей алады, сонымен бірге басқа негізгі ұлпалық ақуыздарды ыдыратады, бұл етті ет құрылымына әкеледі.[11] Цинибаиннің байланысу ерекшелігі актомиозин мен I типті коллагеннің гидролизденуін қамтамасыз етеді.
Zingibain хош иістендіру үшін де қолданылады шұжықтар және пісірілген өнімдер.[8]
Реннет алмастырғыш
Соңғы 100 жыл ішінде дәстүрлі түрде зімбір протеазы ұйыту үшін қолданылады сүт құру зімбір сүтінен жасалған сүзбе, гель тәрізді Кантон тағамы ыстық сүттен және зімбір шырыны. Сүт ұю қабілеті және зімбір протеазының протеолизге ерекшелігі κ-казеин ферментті әлеуетті көкөніске айналдырыңыз бүйрек ауыстыру үшін ірімшік өндірісі.
Сүт ұюы дәстүрлі түрде бүйрек сияқты көздерден алынған ферменттерді коагуляциялау арқылы жүзеге асырылады. Бүйректе үш химозин изозимдер гидролиздейді κ-казеин, сүттегі негізгі ақуыз фракциясы, арасында Phe105 және Met106. Κ-казеиннің гидрофильді қосалқы аймақтары бөлініп, артында гидрофобты агрегат қалады. Ферменттер осылайша κ-казеинді тұрақсыздандырады мицеллалар және сүттің қатып қалуына себеп болатын гидрофобты ақуыз қалдықтарының шоғырлануын ынталандырыңыз.
Шеңгектің негізгі өндірістік кемшіліктеріне оның шектеулі жеткізілімі мен қымбаттығы, қол жетімсіздігі жатады вегетарианшылар және практикалық мүшелер діни топтар, және пайдалануға Еуропалық ұлттық тыйымдар рекомбинантты бұзау рента.[13] Саңырауқұлақ протеазалары көбінесе бүйрек алмастырғыштар ретінде жарамсыз және көптеген өсімдік сығындыларындағы ферменттер төмен өнімділікті, нашар текстураны және ірімшіктің ащы дәмін беретіні дәлелденген.[13]
Коммерциялық кемшіліктер
Алайда, зімбір сығындысынан алынған шикі зімбір протеазы тұрақсыз, а Жартылай ыдырау мерзімі 5 ° C температурасында шамамен 2 күн, бұл коммерциялық қосымшалар үшін қиындық тудырады.[14] Пісіру кезінде ферменттің жартылай шығарылу кезеңі оның тиімділігіне кедергі жасамаса да, сақтаудың төмен тұрақтылығы коммерцияландыру үшін жақсартуды қажет етеді.
Ірі өндіріс үшін ферментті тұрақтандырудың коммерциялық әрекеттері еркінді инактивациялаудың әлеуетті әдістерін зерттеді сульфгидрил тобы ферменттің белсенді аймағында. Механикалық мүмкіндіктерге сульфгидрилді тотықтырып, онымен алмасу жатады дисульфидті көпірлер, қалыптастыру хинон -тиол қосымшалары немесе сульфгидрилді а-мен байланыстырады ауыр металл ионы.[14] 0.2% натрий аскорбаты Зинибаинды 5 ° C температурада 14 күнге дейін тұрақтандыратыны анықталды, ал салыстырмалы концентрациялары EDTA және CaCl2 тұрақтылыққа минималды әсер етті.[14]
Zingibain арқылы өзін-өзі өшіру байқалды автолиз, оны белсенді сульфгидрил тобымен әрекеттесу арқылы алдын-ала босатуға болады цистин немесе PCMB.[14]
Ацетон ұнтақтар - бұл цингабинді тұрақтандырудың өміршең коммерциялық әдісі. Гидрофобты зауыттан кейін полифенолдар шикі зімбірден алынады, тамыр целлюлозасын дегидратациялау үшін ацетон ұнтағы төмен температурада енгізіледі.[14] Фермент су белсенділігінің төмендеуі, өсімдік пигменттерінің төмен концентрациясы және төменгі температурада қатты 3D құрылымдар есебінен тұрақтанады.[14]
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ а б c г. e f ж сағ мен Choi KH, Laursen RA (2000). «Zingiber officinale зімбір тамырынан алынған пролин ерекшелігі бар цистеин протеазаларының аминқышқылдық тізбегі және гликан құрылымдары». Еуро. Дж. Биохим. 267 (5): 1516–26. дои:10.1046 / j.1432-1327.2000.01152.x. PMID 10691991.
- ^ Охцуки К, Тагучи К, Сато К және т.б. (1995). «Зімбір протеазаларын DEAE-Сефароз және изоэлектрлік фокустау арқылы тазарту». Биохим. Биофиз. Акта. 1243 (2): 181–4. дои:10.1016 / 0304-4165 (94) 00145-n. PMID 7873561.
- ^ а б c г. e f Чой К.Х., Лаурсен Р.А., Аллен К.Н. (1999). «Zingiber officinale зімбір тамырынан алынған пролиндік ерекшелігі бар цистеин протеазасының 2.1 құрылымы». Биохимия. 38 (36): 11624–33. дои:10.1021 / bi990651b. PMID 10512617.
- ^ Huang XW, Chen LJ, Luo YB және басқалар. (2011). «Зімбір протеазының тазартылуы, сипаттамасы және сүттің коагуляциялық қасиеттері». J. Dairy Sci. 94 (5): 2259–69. дои:10.3168 / jds.2010-4024. PMID 21524515.
- ^ а б 喜 美 代, 道;初 世, 佐 々;芳 江, 市 川 (1973). «シ ョ ウ ガ た ん 分解 酵素 の 分離 精製». 栄 養 と 食糧 (жапон тілінде). 26 (6): 377–383. дои:10.4327 / jsnfs1949.26.377. ISSN 1883-8863.
- ^ а б c Rzychon M, Chmiel D, Stec-Niemczyk J (2004). «Цистеин протеазаларының тежелу режимдері». Acta Biochimica Polonica. 51 (4): 861–73. PMID 15625558.
- ^ а б c Томпсон Э.Х., Қасқыр идентификаторы, Аллен CE (1973). «Зімбір тамыр: протеолитикалық ферменттердің жаңа көзі». J. Food Sci. 38 (4): 652–655. дои:10.1111 / j.1365-2621.1973.tb02836.x.
- ^ а б c г. Ли Ю.Б., Сехнерт DJ, Ashmore CR (1986). «Зімбір ризома протеазымен етді тендерлеу». J. Food Sci. 51 (6): 1558–1559. дои:10.1111 / j.1365-2621.1986.tb13860.x.
- ^ а б c Grudkowska M, Zagdanńska B (2004). «Өсімдіктер цистеин протеиназаларының көпфункционалды рөлі». Acta Biochimica Polonica. 51 (3): 609–24. дои:10.18388 / abp.2004_3547. PMID 15448724.
- ^ Ха М, Бекхит А.Е., Карне А және т.б. (2012). «Тауарлық папаин, бромелейн, актинидин және цинибаин протеаза препараттарының сипаттамасы және олардың ет белоктарына қатысты белсенділігі». Азық-түлік химиясы. 134 (1): 95–105. дои:10.1016 / j.foodchem.2012.02.071.
- ^ а б c Ким М, Гамильтон SE, Гуддат LW және т.б. (2007). «Өсімдік коллагеназы: зімбірден шыққан цистеин протеазаларының ерекше коллагенолитикалық белсенділігі». Биохим. Биофиз. Акта. 1770 (12): 1627–35. дои:10.1016 / j.bbagen.2007.08.003. PMID 17920199.
- ^ Ай SS (2018). «Протеолитикалық ферменттер мен зімбір сығындысының М.-ның тендерленуіне әсері. кеуде қуысы Holstein Steer-ден ». Жануарлар ресурстарының тамақтану ғылымдары бойынша Корея журналы. 38 (1): 143–151. дои:10.5851 / косфа.2018.38.1.143. PMC 5932962. PMID 29725232.
- ^ а б Хашим М.М., Миншенг Д, Икбал М.Ф. және т.б. (2011). «Зімбір тамырлары сүтті коагуляциялайтын цистеин протеазының әлеуетті көзі ретінде». Фитохимия. 72 (6): 458–64. дои:10.1016 / j.hytochem.2010.12.002. PMID 21353685.
- ^ а б c г. e f Adulyatham P, Owusu-Apenten R (2005). «Зімбір тамырынан протеазды тұрақтандыру және ішінара тазарту (Zingiber offinale Розко) »деп аталады. J. Food Sci. 70 (3): C231-C234. дои:10.1111 / j.1365-2621.2005.tb07130.x.
Сыртқы сілтемелер
- Zingipain АҚШ ұлттық медицина кітапханасында Медициналық тақырып айдарлары (MeSH)
