ENTH домені - ENTH domain
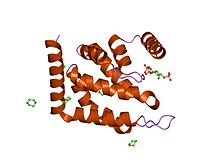 Epsin-1 ENTH домені.[1] | |||||||||
| Идентификаторлар | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Таңба | ENTH | ||||||||
| Pfam | PF01417 | ||||||||
| InterPro | IPR001026 | ||||||||
| PROSITE | PDOC50942 | ||||||||
| SCOP2 | 1еду / Ауқымы / SUPFAM | ||||||||
| OPM суперотбасы | 38 | ||||||||
| OPM ақуызы | 1сағ | ||||||||
| CDD | CD03571 | ||||||||
| |||||||||
The эпсин N-терминал гомологиясы (ENTH) домені Бұл құрылымдық домен қатысатын ақуыздарда болады эндоцитоз және цитоскелеттік техника.
Құрылым
Бұл доменнің ұзындығы 150-ге жуық аминқышқылдары және әрдайым ақуыздардың N-термининінде орналасқан. Домен әр түрлі ұзындықтағы ілмектермен қосылған тоғыз альфа-спиралдан тұратын ықшам шар тәрізді құрылымды құрайды. Жалпы топологияны үш бұрауышпен анықтайды, олар оң қолдың бұралуымен қатарынан жинақталады.[2] N-терминалды спираль кері бүктеліп, Ins (1,4,5) P3 лигандасын байланыстыратын қалтаны құрайтын терең терең ойықты құрайды.[1] Липидті лиганд қоршаған альфа-спиральдардың қалдықтарымен үйлеседі және барлық үш фосфаттар координацияланған.
Липидті екі қабатты қабатпен өзара әрекеттесу
Бұл доменді қамтитын ақуыздардың байланысы анықталды PtdIns (4,5) P2 және Ins (1,4,5) P3 домен мембранамен өзара әрекеттесетін модуль екендігі туралы айтады. Бұл доменді қамтитын ақуыздардың негізгі функциясы қосымша болып табылады клатрин эндоцитоздағы адаптерлер, эпсин липидті моноқабатта клатрин полимеризациясын жинауға және ілгерілетуге қабілетті, бірақ сигнал беру мен актинді реттеуде қосымша рөлдерге ие болуы мүмкін.[3] Эпсин мембрананың қисаюы мен тубуляциясының күшті дәрежесін тудырады, тіпті мембраналардың фрагментациялануы жоғары PtdIns (4,5) P2 мазмұны. Эпсиннің мембраналармен байланысуы олардың бас деформациясын жеңілдетеді, N-терминал спиралын екі қабатты ішкі параққа енгізіп, бас топтарын алшақтатады. Бұл мембрананы весикулаға иілу үшін қажет энергияны азайтып, клатрин торының қисық мембрананы бекітуін және тұрақтандыруын жеңілдетеді. Бұл эпсиннің көпіршікті бүршіктенудегі алғашқы рөлін көрсетеді, өйткені ол қозғаушы күшті де, мембрана инвагинациясы мен клатрин полимеризациясы арасындағы байланысты да қамтамасыз етеді.
Атап айтқанда, эпсин-1 мембраналық гликофосфолипидтің ерекшелігін көрсетеді фосфатидилинозитол-4,5-бисфосфат дегенмен, барлық ENTH домендері бұл молекуламен байланыспайды. Байланыстыру тубуляцияны тудырады липосомалар және in vivo бұл мембранамен байланыстыратын функция әдетте үйлесімді клатрин полимеризация.
Бұл доменнің N-терминалы альфа-спиралы гидрофобты және сына тәрізді мембранаға енеді және мембрананың қисаюын басқаруға көмектеседі.
Осы доменді қамтитын адам ақуыздары
Әдебиеттер тізімі
- ^ а б Ford MG, Mills IG, Peter BJ және т.б. (Қыркүйек 2002). «Эпсинмен қозғалатын клатринмен жабылған шұңқырлардың қисаюы». Табиғат. 419 (6905): 361–6. дои:10.1038 / табиғат01020. PMID 12353027. S2CID 4372368.
- ^ Чен Х, Бэтмен А, де Камилли П, Химан Дж, Панепуччи Е, Брунгер AT (2002). «ENTH домені». FEBS Lett. 513 (1): 11–18. дои:10.1016 / S0014-5793 (01) 03306-3. PMID 11911874. S2CID 25544319.
- ^ Кей Б.К., Ямабхай М, Уендланд Б, Эмр SD (1999). «Эндоциттік және цитоскелетикалық аппараттың болжамды компоненттері бөлісетін жаңа доменді анықтау». Ақуыз ғылыми. 8 (2): 435–8. дои:10.1110 / ps.8.2.435. PMC 2144257. PMID 10048338.
