Өлім эффекторы домені - Death effector domain
| Өлім эффекторы домені | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 FADD (Mort1) өлім эффекторы доменінің құрылымы.[1] | |||||||||||
| Идентификаторлар | |||||||||||
| Таңба | ЖСҚ | ||||||||||
| Pfam | PF01335 | ||||||||||
| InterPro | IPR001875 | ||||||||||
| SMART | ЖСҚ | ||||||||||
| PROSITE | PS50168 | ||||||||||
| SCOP2 | 1а1з / Ауқымы / SUPFAM | ||||||||||
| CDD | CD00045 | ||||||||||
| |||||||||||
The өлім эффекторы (ЖСҚ) - бұл тек эукариоттарда болатын ақуыздың өзара әрекеттесу саласы, ол әртүрлі жасушалық сигнал беру жолдарын реттейді.[2] DED домені белсенді емес күйде болады сатып алу (цистеин протеазалары ) және апоптоз каскадындағы каспазаның активтенуін реттейтін ақуыздар Құрамында ақуыз бар FAS-мен байланыстыратын өлім (FADD ). FADD procaspase 8 және procaspase 10-ны өліммен туындаған сигнал беру кешеніне (DISC) қосады. Бұл жалдау проаспазаза DED және екінші DED арасындағы гомотиптік өзара әрекеттесу арқылы жүзеге асырылады, бұл өлім эффекторы домені адаптер ақуызы бұл белсендірілген TNF рецепторларымен тікелей байланысты. Кешенді түзілу прокаспазаның белсенді каспаза түрінде протеолитикалық активтенуіне мүмкіндік береді, нәтижесінде иницирленеді апоптоз (жасуша өлімі). Құрылымдық жағынан DED домені - бұл ақуыз мотивінің кіші класы өлім қатпарлары құрамында алты альфа-спираль бар, олар құрылымға өте ұқсас Өлім домені (DD).
Құрылым

DED - DD супфамиласының қосалқы отбасы (осы суперотбасыдағы басқа танымал домендер: каспаза-жалдау домені (CARD), пириндік домен (PYD) және өлім домені (DD)). Субфамилиялар құрылымдық жағынан бір-біріне ұқсайды, олардың барлығы (және, атап айтқанда, DED) 6 альфа-спиралдан тұратын бумадан тұрады, бірақ олардың беткі ерекшеліктері әр түрлі.
Толық бастапқы құрылым осы протеиндік доменнің консенсус анықталмаған. Кейбір зерттеулерде 2-184 қалдықтары сипатталған, бірақ C-терминалы мен N-терминалының қалдықтары әлі анықталмаған. DED-ге ерігіштігі мен агрегациясын анықтайтын аминқышқылдарының болуы каспаза-8 және MC159 сияқты әр түрлі белоктардағы DED-ді анықтауға мүмкіндік берді. The екінші реттік құрылым доменнің, айтылғандай, 6 альфа-спиральмен салынған.
The үшінші құрылым доменнің сипаттамасы кристалдану туралы 8-бөлім адамда. Құрылымды сипаттау үшін рентген сәулесінің дифракциясы және алынған ажыратымдылық 2,2 is әдісі қолданылды.[3] Бұл ақуыздағы ЖСҚ асимметриялық бірлікті көрсетеді күңгірт, оның интерфейсінде жіп тәрізді құрылым ретінде көрінетін екі сутектік байланыс желісі бар. DED функциясы оның құрылымымен анықталады. Белгілі болғандай, каспазаны белсендіретін және апоптозды қоздыратын гомотиптік өзара әрекеттесулер серіктестер арасындағы асимметриялық беттік байланыстар арқылы жүзеге асады (каспаза-8 жағдайындағы DED1 және DED2 сияқты).[4] Беттерді құрайтын қалдықтар әдетте зарядталған амин қышқылдары болып табылады, бірақ доменнің интерактивті бетінде қысқа гидрофобты патч байқалуы мүмкін.
Функция
DED домені апоптоздағы рөлімен танымал. Алайда құрамында DED бар ақуыздар басқа жасушалық процестерге де қатысады, сондықтан олар өмір мен өлім жасушаларының шешімдерін басқарады.
Сыртқы апоптоз
[5] Апоптоз - организмнің өмірлік циклі кезінде артықшылықтар беретін жасушаның бақыланатын және бағдарламаланған өлімі. Сыртқы жолды протеаздар отбасы басқарады, олар өлім стимулдарына жауап ретінде белсенді болады. Осы процесстегі ЖСҚ рөлін білу үшін мультипротеинді өліммен қоса сигналдық кешеннің (DISC) түзілуін байқау маңызды.
DR4, TRAIL-R2 және CD95 өлім рецепторлары (мүшелері TNF рецепторлары ) олардың жасушалық жасушаларының көмегімен өзара әрекеттеседі өлім домендері (DD). Құрамында DED бар ақуыздың FADD DD-і осы сипатталған ДД-мен әрекеттесе алады. Мұнда FADD DED-тің функциясы - FADD-ны өзімен байланыстыру арқылы тұрақтандырылған құрылым құру.

[6] Бұл өзара әрекеттесулер α1 / α4 және α2 / α3 спиральдарымен анықталады: α1 / α4-тен Ser1, Val6, His9, Leu43, Asp44 және Glu51 қалдықтары Thr21, Phe25, Lys33, Arg34, Glu37 және Glu51 α2 / α3 байланыстарында. екінші молекула. Әрбір өзара әрекеттесу 1062 area ауданын қамтиды2 және гидрофобты бүйірлік тізбектерден, сутегімен байланысқаннан және тұзды көпірлерден алынған үлестер. Соңғы гомодимер құрылымға бағытталған, сондықтан әрбір суббірлікте 2 өзара әрекеттесу орны болады.
Procaspase-8, сонымен қатар құрамында DED бар ақуыз, FADD DED-ге жақындыққа ие. Сондықтан олар FADD-ге өздерінің ЖСҚ-ы арқылы мономерлер ретінде қабылданады. Бұл өзара әрекеттесу прокапаза-8 DED-A α1 / α4 және FADD DED α2 / α3 немесе FADD DED α1 / α4 және прокапаза-8 DED-B α2 / α5 арқылы анықталады. Procaspase-8 DED-B FADD және DED-A-мен өзара әрекеттесіп, капаза-8 тізбегінің түзілуіне аралық жасайды немесе керісінше. Алайда, екі жағдайда да өзара әрекеттесу конформациялық өзгерісті тудыратын прокаспазалар арасында димер құруға әкеледі. Бұл димерация белсенді сайтты құру үшін өте маңызды; p12 суббірлігі босатылады және ол кейінірек p10 кіші бөлімшесіне өңделеді. Прокапаза-8 екі молекуласы осы протеаза-8 жасушаларының белсенді өлімін тудыратын p10 суббірліктерімен байланысты.[7][8]
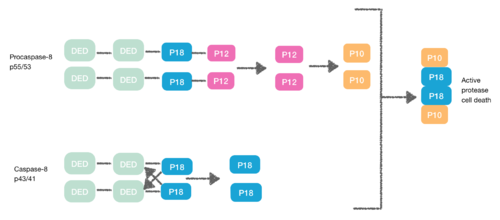
Некроптоз
[9] DISC procaspase-8 құру кезінде FLIP деп аталатын құрамында басқа DED бар ақуызмен гетеродимеризациялауға боладыL. FLIPL’Псевдо-каспазада капед-8-дің N-терминалына өте ұқсас, бірақ активті учаскеде маңызды мутация болатын (Цистеиннен тирозинге дейін) екі тандемді DED бар.
Олардың DED арасында жасалған бұл гетеродимерация қалыпты гомодимерацияның алдын алады, сондықтан псевдо-каспаза апоптотикалық каскадты белсендіре алмайды. FLIPL Жалған каспаза конформациялық өзгерісті қоздыруда тиімдірек. Алайда, FLIPL ферментативті белсенділігі жеткіліксіз, сондықтан DED мен p18 арасында ажырау мүмкін емес. Нәтижесінде протеаза жасушаларының белсенді өлімін құру мүмкін емес.[10]
Procaspase-8 де FLIP көмегімен гетеродимеризация жасай аладыS, сонымен қатар құрамында ақуыз бар DED. Бұл жағдайда гетеродимеризация тікелей procaspase-8-ді белсендіре алмайды, өйткені бастапқы конформациялық өзгеріс procaspase-8 каспаза доменінде жүре алмайды.[10]

Осылайша, DED апоптоз каскадын тежей алады және оның салдары некроптоз.
DED ақуыздар отбасы
Құрамында DED бар ақуыздар
Каспаза-8 және каспаза-10
[11] Каспалар цистеин протеазалары кезінде ұяшықты бөлшектеуге жауапты апоптоз.
Бұл белоктар зимогендер болып табылады және молекула ішіндегі белгілі бір жерлерде бөлінгеннен кейін белсенді болады.
Құрылым:
- Өлім эффекторы домені (DED) және a Caspase жалдау домені (CARD) N-терминалда орналасқан про-домен деп аталатын құрылымға енген
- C-терминалындағы каталитикалық протеаза домені.
Екі топ бар протеаздар:
- Эффекторлы каспаздар: апоптоз кезінде болатын морфологиялық өзгерістердің ең үлкен бөлігін тудырады.
- Бастамашы каспаздар: эффекторлық каспалардың активтенуіне жауап береді. Бұл каспаздар арқылы іске қосылады олигомеризация және белокты функционалды ететін бөлу.
Каспазаның про-доменіндегі екі тандемді DED индукцияны тудырады ақуыз-ақуыздың өзара әрекеттесуі сияқты басқа ақуыздармен бірге жүреді FADD.
Каспаларды зерттеу өте маңызды, өйткені олар тек апоптозды бақыламайды, сонымен қатар жасушаның қажеттілігіне байланысты оны тежейді. Ғалымдар олардың жасуша тіршілігін реттейтін механизм екенін және онкологиялық терапия үшін маңызы зор екенін анықтады.
FLICE тәрізді тежегіш ақуыздар (FLIP)
FLICE тәрізді тежегіш ақуыздар (FLIP) - бұл өлім рецепторларының сигналын тоқтатуға қабілетті жасушалық ингибиторлар, бұл жасушалардың апоптозын тудырады.
Бірінші анықталған FLIP-ді γ-герпес вирустары көрсетті, сондықтан оларды v-FLIP деп атады. Бұл v-FLIP ішіндегі рецептормен байланыса алды өлім тудыратын сигнал беру кешені (DISC), CD95 арқылы жүзеге асырылатын апоптозды бұғаттау.
[12]vFLIP негізінен екі кезекті DED-ді қамтиды, олар каспаза-8 N-терминалына өте гомологты.
[10] The ұялы v-FLIP-тің гомологтары әдетте екі формада көрінеді:
- c-FLIPS (қысқасы): онда аминоканалдың тандемі бар DED, содан кейін қысқа карбокси-терминал бөлімі бар. Оның құрылымы вирустық FLIP-ге ұқсас.
- c-FLIPL (ұзын): ол тек DED тандемінен ғана емес, сонымен қатар протеаза белсенділігі үшін амин қышқылдарының мутациясы бар протеаза тәрізді доменден (каспаза-8-ге гомологты), оның ішінде цистеиннің белсенді учаскесінен тұрады.
[12] C-FLIP-тің екі түрі де CD95 DISC жобасына жатады, олар каспаза-8-мен гетеродимерленеді. c-FLIP CD95 рецепторын жалғаушы альтернативті жолдарға сигнал беруге қатысты NF-κB, JNK және КАРТА жолдар.
PEA-15 / PED
PEA-15 (Фосфопротеин астроциттермен байытылған-15 кДа) ретінде белгілі PED (қант диабетімен байытылған фосфопротеин) Бұл Құрамында DED бар ақуыз бірге плейотропты әсерлер.
PED - N-терминалдан тұратын, каталитикалық емес, кішкентай ақуыз өлім эффекторы домені (DED) және құрылымы дұрыс емес C-терминалы құйрығы.[13] PED / PEA-15 әр түрлі типтегі ақуыздармен өзара әрекеттеседі және DED жоқ және онсыз бұл протеиндерге қосылу ерекшелігі фосфорлану қосулы екі серинді қалдықтар C-терминалының құйрығында:
- Ser104: фосфорланған ақуыз киназ C (PKC).
- 116: үшін субстрат кальций / каламодулинге тәуелді протеинкиназа II (CamKII).
[13] PEA-15 жұмыс істейді антиапоптотикалық DED ақуызы бірнеше каскадты сигнал беру. TNF α-, CD95- және TRAIL-делдалды жолдарда PEA-15 байланыстырады және FADD мен каспаза-8 өзара әрекеттесуін бұзады.
[10] Апоптоздан басқа, PEA-15 бұлшықет жасушаларында инсулинмен қозғалатын глюкозаның тасымалдануын тежейді, сондықтан PEA-15 мРНҚ-ның жоғары деңгейдегі көрінісі қант диабеті II тип.
DEDD / DEDD2
Өлім эффекторының домені бар ДНҚ байланыстырушы (DEDD). Апптозды күшейтетін DEDAF (DED-байланысты фактор) деп аталатын молекуламен байланысқан жерде шамадан тыс экспрессия кезінде нуклеолдарда локализацияланған ДНҚ-ның байланыс қабілеттілігін көрсетеді. Сонымен қатар, ол блоктайды РНҚ-полимераза I транскрипция ДНҚ-ға қосылу арқылы.
DEDD2 (FLAME-3) - аминқышқылдық реттік 48,5% бөлісетін DEDD гомологы. C-FLIP және DEDD-мен өзара әрекеттесетіні және маңызды рөл атқаратыны атап өтілді полимераза II - тәуелді транскрипциялық репрессия.
HIP-1 және HIPPI
Хантингтин өзара әрекеттесетін протеин-1 (HIP-1) өзара әрекеттесетін ақуыз болып табылады аң аулау (Htt), мутацияға ұшыраған басқа протеин (кеңейтілген полиглутаминді қайталаумен) науқастардың миында ақуыз агрегаттарын құрайды Хантингтон ауруы (HD).
[14] HIP-1 құрамында а жалған өлім эффекторының домені (pDED), сондықтан HIP-1-нің артық экспрессиясы апоптозды тудырады DED ақуыздары сияқты бірнеше жасушада. Апоптоздың бұл түрі HIP-1 pDED-ге тәуелді және ол Htt-жабайы типті білдіргенде азаятын фермент - каспаза-3 активтенуінен тұрады, бұл факт HIP-1 Htt-пен Htt-пен ынтымақтастықта болатындығын көрсетеді Хантингтон ауруының патомеханизмі.
[10] Ашытқы арқылы екі гибридті скрининг, HIP-1 HIPPI (HIP-1 ақуыздың интеракторы) деп аталатын 419 амин қышқылының ақуызымен өзара әрекеттесетінін көрсетті. Сәтті тәжірибелер мұны анықтады HIPPI болуы HIP-1 индукцияланған апоптозды анықтайды.
ФЛАШ
FLICE-мен байланысты үлкен ақуыз. DED-ге ұқсас доменді қамтиды, бірақ гомология өте әлсіз және оның қызметі әлі де түсініксіз.
Терапиялық пайдалану ЖСҚ
[7] DED кешендері өмір мен өлім жасушаларының процестерін басқаратын шешуші сатыларда жұмыс істейтіндігі көрсетілген. Бұл білім терапияда әсіресе пайдалы, себебі жасуша тіршілігін қалыптан тыс басқаруға байланысты көптеген патологиялар бар.
Апоптоздың болмауы қатерлі ісіктің ерекшелігі болып табылады. Кейбір жағдайларда прокаспаза-8 кодтайтын ген метилдену арқылы тынышталады, сондықтан белсенді протеазға ие болу үшін эпигенетикалық емдеу әдістерін қолдана отырып генді белсендіру қажет. Басқа жағдайларда, белсенді каспазаның пайда болуына жол бермейтін антиапоптотикалық молекула, FLIP экспрессиясы байқалады. Бұл жағдайда қатерлі ісікке қарсы агенттер бар, олар FLIP экспрессиясын төмендетеді.
Алайда, аномальды апоптоз тек қатерлі ісікке жатпайды, қабыну және нейродегенеративті аурулар сияқты басқа патологиялар бар, оларды терапевтикалық әдістермен емдеуге болады.
Әдебиеттер тізімі
- ^ Эберштадт М, Хуанг Б, Чен З және т.б. (Сәуір 1998). «FADD (Mort1) өлім-эффекторлық аймағының NMR құрылымы және мутагенезі». Табиғат. 392 (6679): 941–5. дои:10.1038/31972. PMID 9582077. S2CID 4370202.
- ^ Valmiki MG, Ramos JW (наурыз 2009). «Өлім эффекторы бар ақуыздар». Ұяшық. Мол. Life Sci. 66 (5): 814–30. дои:10.1007 / s00018-008-8489-0. PMID 18989622. S2CID 13117680.
- ^ Шен, Чен; Юэ, Хонг; Пей, Цзянуэн; Гуо, Сяомин; Ван, Дао; Quan, Jun-Min (2015). «Каспаза-8 өлім эффекторы домендерінің кристалдық құрылымы». Биохимиялық және биофизикалық зерттеулер. 463 (3): 297–302. дои:10.1016 / j.bbrc.2015.05.054. ISSN 0006-291X. PMID 26003730.
- ^ «Жасуша өліміндегі құрылымдар, домендер және функция».
- ^ Элмор, Сюзан (2007). «Апоптоз: Бағдарламаланған жасуша өліміне шолу». Токсикологиялық патология. 35 (4): 495–516. дои:10.1080/01926230701320337. ISSN 1533-1601. PMC 2117903. PMID 17562483.
- ^ Сингх, Ниту; Хасан, Әли; Бозе, Каколи (2015). «Домен тізбегін құрайтын эффекторлық өлім эффекторының негізі және оның каспаза-8 активациясындағы маңызы». FASEB журналы. 30 (1): 186–200. дои:10.1096 / fj.15-272997. ISSN 1530-6860. PMID 26370846.
- ^ а б Райли, Дж.С; Малик, А; Холохан, С; Longley, DB (2015). «ЖСҚ немесе тірі: өлім эффекторы домен кешендерін жинау және реттеу». Жасушалардың өлімі және ауруы. 6 (8): e1866. дои:10.1038 / cddis.2015.213. ISSN 2041-4889. PMC 4558505. PMID 26313917.
- ^ Яо, Джан; Дуань, Шаншань; Хоу, Дежи; Хиз, Клаус; Ву, Миан (2007). «Каспаза-8 / Mch5 өздігінен бөлінетін өнімі DEDa өлім эффекторы, ERK1 / 2 байланыстыру арқылы ядроға ауысады және р53 тәуелді механизм арқылы прокаспаза-8 өрнегін реттейді». EMBO журналы. 26 (4): 1068–1080. дои:10.1038 / sj.emboj.7601571. ISSN 1460-2075. PMC 1852837. PMID 17290218.
- ^ Ли, Юн-Ву; Сео, Джинхо; Чжон, Манхён; Ли, Сангсик; Ән, Джаван (2012). «Сыртқы апоптоз бен некроптоздағы FADD рөлі». BMB есептері. 45 (9): 496–508. дои:10.5483 / BMBRep.2012.45.9.186. ISSN 1976-670 жж. PMID 23010170.
- ^ а б c г. e Барнхарт, Брайан С; Ли, Джастин С; Алаппат, Элизабет С; Питер, Маркус Е (2003). «Ақуыздардың доменді өлім эффекторы». Онкоген. 22 (53): 8634–8644. дои:10.1038 / sj.onc.1207103. ISSN 0950-9232. PMID 14634625.
- ^ Шлейх, К .; Бухбиндер, Дж. Х .; Пьеткевич, С .; Кахне Т .; Уоркен, У .; Өзтүрік, С .; Шнольцер, М .; Науманн М .; Krammer, P. H. (2016-04-01). «DISC кезіндегі DED тізбектерінің молекулалық архитектурасы: қысқа DED ақуыздарымен c-FLIP және procaspase-8 продоменімен прокаспаза-8 активациясын реттеу». Жасушаның өлімі және дифференциациясы. 23 (4): 681–694. дои:10.1038 / cdd.2015.137. ISSN 1350-9047. PMC 4986640. PMID 26494467.
- ^ а б Ю, JW; Shi, Y (2008). «FLIP және өлім эффекторы доменінің отбасы». Онкоген. 27 (48): 6216–6227. дои:10.1038 / onc.2008.299. ISSN 0950-9232. PMID 18931689.
- ^ а б Твуми, Эдвард С; Кордаско, Дана Ф; Вэй, Юфенг (2012). «ERK2 кешеніндегі PED / PEA-15 терең конформациялық өзгерістері NMR магистральдық динамикасы арқылы анықталды». Biochimica et Biofhysica Acta (BBA) - ақуыздар және протеомика. 1824 (12): 1382–1393. дои:10.1016 / j.bbapap.2012.07.001. ISSN 1570-9639. PMID 22820249.
- ^ Бхаттачария, Нитай П; Банерджи, Маниша; Majumder, Pritha (2008). «Хантингтон ауруы: апоптоз бен транскрипцияны реттеудегі аңшылықпен өзара әрекеттесетін белок 1 (HIP-1) және оның молекулалық серіктесі HIPPI рөлі». FEBS журналы. 275 (17): 4271–4279. дои:10.1111 / j.1742-4658.2008.06563.x. ISSN 1742-464X. PMID 18637945.
