BAR домені - BAR domain
| BAR домені | |||||||||
|---|---|---|---|---|---|---|---|---|---|
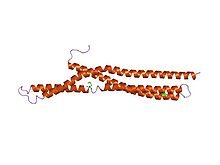 Амфифизин BAR құрылымы.[1] | |||||||||
| Идентификаторлар | |||||||||
| Таңба | БАР | ||||||||
| Pfam | PF03114 | ||||||||
| InterPro | IPR004148 | ||||||||
| SMART | SM00721 | ||||||||
| PROSITE | PDOC51021 | ||||||||
| SCOP2 | 1uru / Ауқымы / SUPFAM | ||||||||
| CDD | CD07307 | ||||||||
| |||||||||
Молекулалық биологияда, BAR домендері бұл жасушадағы мембраналық динамикаға қатысатын көптеген ақуыздарда кездесетін ақуыздың димеризациясының жоғары деңгейлері. BAR домені банан тәрізді және мембранамен ойыс беті арқылы байланысады. Ол қисық мембраналармен байланыстыру арқылы мембрананың қисаюын сезінуге қабілетті. BAR домендері үш ақуыздың атымен аталған: Bin, Амфизин және Rvs.
BAR домендері басқа домендермен үйлесімде пайда болады
Көптеген BAR отбасылық протеиндері липидтің спецификалық ерекшелігінің альтернативті домендерін қамтиды, бұл ақуызды белгілі бір мембраналық бөліктерге бағыттауға көмектеседі. Кейбіреулерде бар SH3 домендері байланыстырады динамин және амфифизин мен эндофилин тәрізді ақуыздар везикулалар скисцинасын ұйымдастыруға қатысады.
N-BAR домені
Ақуыздары бар кейбір BAR доменінде BAR доменінің алдында N-терминалды амфипатикалық спираль бар. Бұл спираль мембранаға (эпсин ENTH доменіндегі сияқты) кіреді және қисықтықты тудырады, ол BAR димерімен тұрақталады. Амфифизин, эндофилин, BRAP1 / bin2 және надрин - құрамында ан N-BAR. Дрозофила амфифизині N-BAR (DA-N-BAR) - теріс зарядталған беттерді таңдаған ақуыздың мысалы.[1]
F-BAR (EFC) домені
F-BAR домендері (FCH-BAR үшін немесе кеңейтілген FCH гомологиясы үшін EFC) - бұл бұрыннан орнатылған FCH доменінің кеңейтімдері болып табылатын BAR домендері. Олар белоктардың амин терминде жиі кездеседі. Олар липидті мембраналарды байланыстыра алады және липидтерді in vitro және in vivo тубуляциялай алады, бірақ олардың нақты физиологиялық рөлі әлі зерттелуде.[2] F-BAR домендерінің мысалдары CIP4 / FBP17 / Toca-1, Syndapins (PACSINs деп те аталады) және мунициндер. Тышқандардағы синдапин I генін нокаутқа ұшыратқаны, синдапиндер тұқымдасының миға бай изоформасы синаптикалық көпіршіктердің мөлшерін дұрыс бақылау үшін өте маңызды және сол арқылы анықтауға көмектеседі мембрананың қисаюы физиологиялық процесс. Бритта Квалманн зертханасының жұмысы синдапин I-дің үлкен GTPase-ге дұрыс бағытталуы үшін өте маңызды екенін көрсетті. динамин мембраналарға дейін.[3]
Нексиндерді сұрыптау
The нексинді сұрыптау ақуыздар тұқымдасына BAR доменін иеленетін бірнеше мүшелер кіреді, соның ішінде жақсы сипатталған SNX1 және SNX9.
Осы доменді қамтитын адам ақуыздары
AMPH; ARHGAP17; BIN1; BIN2; BIN3; DNMBP; GMIP; БАЙ 2; SH3BP1;SH3GL1; SH3GL2; SH3GL3; SH3GLB1; SH3GLB2;
Сондай-ақ қараңыз
Сыртқы сілтемелер
Әдебиеттер тізімі
- ^ а б Питер Б.Ж., Кент Х.М., Миллс IG және т.б. (2004 ж. Қаңтар). «BAR домендері мембраналық қисықтық датчиктері: амфифизин BAR құрылымы». Ғылым. 303 (5657): 495–9. дои:10.1126 / ғылым.1092586. PMID 14645856. S2CID 6104655.
- ^ Qualmann B, Koch D, Kessels MM (тамыз 2011). «Бананға барайық: эндоциттік BAR кодын қайта қарау». EMBO J. 30 (17): 3501–15. дои:10.1038 / emboj.2011.266. PMC 3181480. PMID 21878992.
- ^ Кох Д, Спивокс-Беккер I, Сабанов В, Синнинг А, Дугладзе Т, Стеллмахер А, Ахужа Р, Гримм Дж, Шулер С, Мюллер А, Ангенштейн Ф, Ахмед Т, Дизлер А, Мозер М, Том Дик С, Спессерт Р. , Boeckers TM, Fässler R, Hübner CA, Balschun D, Gloveli T, Kessels MM, Qualmann B (желтоқсан 2011). «Синаптикалық көпіршіктің дұрыс қалыптасуы және нейрондық желінің белсенділігі синдапин I-ге сенім артады». EMBO J. 30 (24): 4955–69. дои:10.1038 / emboj.2011.339. PMC 3243622. PMID 21926968.
Әрі қарай оқу
- Leventis PA, Chow BM, Stewart BA, Iyengar B, Campos AR, Boulianne GL (қараша 2001). «Дрозофила Амфифизин - бұл қалыпты қозғалу үшін қажет, бірақ эндоцитоз емес постсинапстық ақуыз». Трафик. 2 (11): 839–50. дои:10.1034 / j.1600-0854.2001.21113.x. PMID 11733051.
- Чжан Б, Зельхоф AC (шілде 2002). «Амфифизиндер: синаптикалық көпіршікті қайта өңдеу және мембрана динамикасы үшін BAR жоғарылату. Bin-Amhiphysin-Rvsp». Трафик. 3 (7): 452–60. дои:10.1034 / j.1600-0854.2002.30702.x. PMID 12047553.Шолу.
- Zelhof AC, Bao H, Hardy RW, Razzaq A, Zhang B, Doe CQ (желтоқсан 2001). «Амфизин дрозофиласы белокты оқшаулауға және мембрана морфогенезіне қатысады, бірақ синапстық көпіршік эндоцитозында емес». Даму. 128 (24): 5005–15. PMID 11748137.
- Мэтью Д, Попеску А, Будник V (қараша 2003). «Фазиклин II мембранасының циклдік синапстық циклі кезінде амфифизин дрозофиласы». Дж.Нейросчи. 23 (33): 10710–6. дои:10.1523 / JNEUROSCI.23-33-10710.2003. PMC 6740931. PMID 14627656.
- Питер Б.Ж., Кент Х.М., Миллс IG және т.б. (2004 ж. Қаңтар). «BAR домендері мембраналық қисықтық датчиктері: амфифизин BAR құрылымы». Ғылым. 303 (5657): 495–9. дои:10.1126 / ғылым.1092586. PMID 14645856. S2CID 6104655.
- Weissenhorn W (тамыз 2005). «Эндофилин-A1 BAR доменінің кристалдық құрылымы». Дж.Мол. Биол. 351 (3): 653–61. дои:10.1016 / j.jmb.2005.06.013. PMID 16023669.
- Gallop JL, Jao CC, Kent HM және т.б. (Маусым 2006). «Эндофилин N-BAR домендік-мембраналық қисықтық механизмі». EMBO J. 25 (12): 2898–910. дои:10.1038 / sj.emboj.7601174. PMC 1500843. PMID 16763559.
- Масуда М, Такеда С, Соне М және т.б. (Маусым 2006). «Эндофилин BAR домені құрылымға негізделген екі жаңа механизммен мембрананың қисаюын басқарады». EMBO J. 25 (12): 2889–97. дои:10.1038 / sj.emboj.7601176. PMC 1500852. PMID 16763557.
- Frost A, Perera R, Roux A және т.б. (Наурыз 2008). «F-BAR домендерінің мембраналық инвагинациясының құрылымдық негіздері». Ұяшық. 132 (5): 807–17. дои:10.1016 / j.cell.2007.12.041. PMC 2384079. PMID 18329367.
