Ставудин - Stavudine - Wikipedia
 | |
 | |
| Клиникалық мәліметтер | |
|---|---|
| Сауда-саттық атаулары | Зерит |
| Басқа атаулар | 2 ′, 3′-дидегидро-2 ′, 3′-дидекситимидин |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a694033 |
| Лицензия туралы мәліметтер | |
| Жүктілік санат |
|
| Маршруттары әкімшілік | Ауыз арқылы |
| ATC коды | |
| Құқықтық мәртебе | |
| Құқықтық мәртебе | |
| Фармакокинетикалық деректер | |
| Биожетімділігі | >80% |
| Ақуыздармен байланысуы | Елемейді |
| Метаболизм | Бүйрек жою (~ 40%) |
| Жою Жартылай ыдырау мерзімі | 0,8-1,5 сағат (ересектерде) |
| Идентификаторлар | |
| |
| CAS нөмірі | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ЧЕМБЛ | |
| NIAID ChemDB | |
| CompTox бақылау тақтасы (EPA) | |
| ECHA ақпарат картасы | 100.169.180 |
| Химиялық және физикалық мәліметтер | |
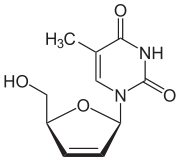
| Формула | C10H12N2O4 |
| Молярлық масса | 224.216 г · моль−1 |
| 3D моделі (JSmol ) | |
| |
| |
| (тексеру) | |
Ставудин (d4T), сауда маркасымен сатылады Зерит басқаларымен бірге антиретровирустық дәрі алдын алу және емдеу үшін қолданылады АҚТҚ / ЖҚТБ.[3] Әдетте оны басқа антиретровирустық препараттармен бірге қолдану ұсынылады.[3] Бұл а-дан кейін алдын-алу үшін қолданылуы мүмкін иненің жарақаты немесе басқа ықтимал әсер ету.[3] Алайда, бұл бірінші сатыдағы емдеу емес.[3] Ол ауыз арқылы беріледі.[3]
Жалпы жанама әсерлерге мыналар жатады бас ауруы, диарея, құсу, бөртпе және перифериялық жүйке мәселелер.[3] Ауыр жанама әсерлерге жатады жоғары қан лактаты, панкреатит, және бауыр ұлғайған.[3] Бұл әдетте ұсынылмайды жүктілік.[3] Ставудин нуклеозидті аналогтық кері транскриптаза ингибиторы (NRTI) дәрілік заттар класы.[3]
Ставудин алғаш рет 1966 жылы сипатталған және 1994 жылы АҚШ-та қолдануға рұқсат етілген.[4] Ол жалпы дәрілік түр ретінде қол жетімді.[3]
Медициналық қолдану
Ставудин емдеуде қолданылады АИВ-1 инфекциясы, бірақ ем емес. Әдетте бұл бастапқы емдеу ретінде ұсынылмайды.[5] Ставудин сонымен бірге вируспен жұмыс кезінде (мысалы, ине) немесе инфекцияланған қанмен немесе басқа дене сұйықтықтарымен байланысқа түскеннен кейін АИТВ-1 инфекциясының даму қаупін төмендетуі мүмкін.[6] Ол әрдайым инфекцияны бақылау және АИТВ асқынуларын азайту үшін басқа АҚТҚ-мен емделеді.[7]
Дүниежүзілік денсаулық сақтау ұйымы (ДДҰ) ставудинді уыттылық деңгейінің жоғарылауына байланысты оны біртіндеп жоюды ұсынады. Егер препаратты қолдану қажет болса, жанама әсерлердің пайда болуын азайту үшін төмен дозаларды қолдану ұсынылады; дегенмен, 2015 ж Кокранды шолу жоғары және төмен мөлшерлеу режимі арасында айқын артықшылық таппады.[8]
Жүктілік және емізу
Ставудин жануарларға жүргізілген зерттеулерде ұрыққа әсер ететіндігі дәлелденген, бірақ адам зерттеулері бойынша мәліметтер жоқ.[1] Жүкті әйелдерге ставудинді, егер оның пайдасы ұрыққа тигізетін зиянынан көп болса ғана енгізу керек. Сонымен қатар, өлімге әкелетін жағдайлар туралы хабарлар болды лактоацидоз ставудин мен аралас терапиясын қабылдайтын жүкті әйелдерде диданозин басқа вирусқа қарсы агенттермен.[1]
The Ауруларды бақылау және алдын алу орталықтары АИТВ жұқтырған аналарға емшек сүті арқылы АИТВ-жұқпасының қаупін болдырмау үшін нәрестелерін емізбеуге кеңес беріңіз.[9] Ставудиннің жануарлардың емшек сүтіне түсетіндігі туралы дәлелдер бар, бірақ адамның емшек сүті туралы мәліметтер жоқ.[1]
Балалар
Ставудин туылғаннан бастап жасөспірім кезіне дейін АИТВ жұқтырған балаларға қауіпсіз. Жағымсыз әсерлері мен қауіпсіздік профилі ересектермен бірдей.[1]
Қарттар
65 жастан асқан АИТВ жұқтырған ересектерде ставудинді қолдану туралы мәліметтер жоқ. Алайда 65 жастан асқан 12000 адамның 30% -ы дамыды перифериялық невропатия.[1] Сонымен қатар, егде жастағы адамдарда бүйрек функциясы төмендегендіктен, оларда уытты жанама әсерлер пайда болуы мүмкін.[10]
Жағымсыз оқиғалар
Жалпы жанама әсерлер[1]
- Жүрек айнуы
- Құсу
- Диарея
- Бас ауруы
- Аш қарын
Ауыр жанама әсерлер[1]
- Перифериялық невропатия
- Лактоацидоз
- Панкреатит
- Гепатотоксичность
- Гепатомегалия бірге стеатоз
- Липоатрофия /липодистрофия (майды қайта бөлу / жинақтау)
Жеке адамдар осы жағымсыз әсерлердің дамуына бақыланады. Перифериялық нейропатияның дамуы дозаға байланысты екендігі көрсетілген, сондықтан препарат тоқтатылған жағдайда шешілуі мүмкін. АИВ-1 ауруының жоғарылауы бар адамдар, анамнезінде перифериялық нейропатия немесе нейропатиямен байланысы бар басқа дәрілерге тәуелді адамдар бұл жанама әсерді жиі дамытады.[1]
Ставудин зертханалық тексерісте көрсетілген генотоксикалық, бірақ клиникалық дозаларымен бірге канцерогенді әсерлер жоқ. Гиперлактатемия, сүйектің минералды тығыздығы (BMD) жоғалту, аяқ-қол майының төмендеуі және ұлғаюы триглицеридтер жоғары дозада енгізген кезде табылды. Бұл вирусқа қарсы препараттардың бірі болуы мүмкін липодистрофия және осы себепті ол дамыған елдердегі пациенттердің көпшілігі үшін тиісті емдеу болып саналмайды.
HLA-B * 4001 Тайландта жүргізілген зерттеуге сәйкес ставудинді болдырмау немесе қысқарту үшін қандай науқастарда ставудинмен байланысты липодистрофия дамитынын болжау үшін генетикалық маркер ретінде қолданылуы мүмкін.[11]
Ол әлі күнге дейін Үндістан сияқты ресурстардың нашар жағдайында бірінші жолдағы терапияда бірінші таңдау ретінде қолданылады. Перифериялық нейропатия немесе жүктілік дамыған жағдайда ғана ол келесі таңдауға ауысады, зидовудин. Дозаны титрлеудің қауіпсіздігі мен тиімділігі аңғал науқастарда емделмеген. Бұл тек тұрақты вирусологиялық супрессиямен ауыратын науқастарда ғана айтылды. Бұл тұжырымдар вирустық жүктемесі жоғары ART аңғал науқастарда қолданылатын Ставудинмен қорытылмаған.
2009 жылғы 30 қарашада, дүйсенбіде Дүниежүзілік денсаулық сақтау ұйымы «[ДДСҰ] ұзақ мерзімді, қайтымсыз жанама әсерлері болғандықтан, елдерге Ставудинді немесе d4T қолдануды тоқтату туралы кеңес береді. Ставудин өзінің арзан бағасына байланысты дамушы елдердегі бірінші қатарлы терапияда әлі де кең қолданылады және қол жетімділігі. Зидовудин (AZT) немесе тенофовир (TDF) аз уытты және бірдей тиімді балама ретінде ұсынылады. «[12]
Қимыл механизмі
Ставудин - бұл нуклеозид аналогтық туралы тимидин. Ол жасуша арқылы фосфорланады киназалар белсенді трифосфатқа айналады. Ставудин трифосфаты АҚТҚ-ны тежейді кері транскриптаза табиғи субстратпен бәсекелесу арқылы, тимидинтрифосфат. Кері транскриптаза - бұл вирустың генетикалық материалын иесінің ДНҚ-на енгізу үшін РНҚ-ның ДНҚ көшірмесін жасау үшін қолданатын фермент. ДНҚ тізбегіне қосылғаннан кейін ставудин трифосфаты оның аяқталуына әкеледі ДНҚ репликациясы.
Фармакокинетикасы
Сіңіру: Ставудиннің тез сіңуі және ауызша биожетімділігі жақсы (F = 0,86).[7]
Тарату: Ставудин қандағы ақуыздармен байланыспайды.[7]
Метаболизм: Ставудиннің клиренсіне бауыр метаболизмі аз әсер етеді. Тотығу және глюкуронизация аз метаболиттер шығарады.[7]
Жою: Ставудин негізінен несепте және көбінесе өзгермеген түрінде шығарылады.[7]
Дәрілермен өзара әрекеттесу
Бір мезгілде қолдану зидовудин ұсынылмайды, өйткені ол жасуша ішіндегі тежелуі мүмкін фосфорлану ставудин. ВИЧ-ке қарсы басқа дәрілерде бұл мүлік жоқ.
Ставудин ақуыздармен байланыспайды және негізгі цитохром P450 изоформаларын тежемейді. Осылайша, осы жолдар арқылы метаболизденетін дәрілік заттармен немесе ақуызмен байланысқан дәрілік заттармен өзара әрекеттесуі екіталай.[7]
Тарих
Ставудинді алғаш рет жасаған Джером Хорвитц 1960 жылдары және бастапқыда D4T деп аталды.[13] ЖИТС эпидемиясы 1980 жылдары болған кезде, Уильям Прусофф және доктор Тай-Шун Лин Ставудиннің АИТВ-ға қарсы қасиеттерін тапты.[14] Фармацевтикалық компания Бристоль-Майерс Скибб есірткіні Zerit сауда атауымен шығарады.[14]
Бұл сонымен қатар 1992 жылы параллель жол статусын алған алғашқы препарат АҚШ-тың Азық-түлік және дәрі-дәрмек әкімшілігі (FDA), бұл агенттікке Ставудинді мақұлданғанға дейін науқастарға қол жетімді етуге мүмкіндік берді. Ставудин FDA жеделдетілген мақұлдау процесі бойынша жіберілді. Осы процесс арқылы Ставудиннің тиімділігі оның әсерімен өлшенді суррогат маркер, CD4, клиникалық соңғы нүктелердің орнына. FDA CD4 жасушалары санының жоғарылауы препараттың ЖҚТБ мен АИТВ-инфекциясына қарсы қаншалықты тиімді болатындығының көрсеткіші болды деген қорытындыға келді. Ставудин 1994 жылы 27 маусымда FDA-мен ЖҚТБ және АИТВ-инфекциясын емдеуге мақұлданған төртінші препарат болды. Тіпті мақұлданғаннан кейін де препараттың клиникалық тиімділігін бағалау бойынша зерттеулер жалғасты. Егер клиникалық артықшылықтар туралы нұсқаулық болмаса, жеделдетілген мақұлдау алынып тасталуы мүмкін.[15]
2018 жылы Mylan Pharmaceuticals компаниясы 20 мг, 30 мг және 40 мг ставудин өндірісін тоқтатты.[16]
Әдебиеттер тізімі
- ^ а б c г. e f ж сағ мен «Ставудин капсуласы». DailyMed. 21 қыркүйек 2019. Алынған 13 қазан 2020.
- ^ «Zerit EPAR». Еуропалық дәрі-дәрмек агенттігі (EMA). Алынған 13 қазан 2020.
- ^ а б c г. e f ж сағ мен j «Кәсіби мамандарға арналған Ставудин монографиясы - Drugs.com». www.drugs.com. Мұрағатталды түпнұсқадан 2016-11-10. Алынған 2016-11-09.
- ^ Фишер, Янош; Ганеллин, К.Робин (2006). Аналогты есірткіні табу. Джон Вили және ұлдары. б. 505. ISBN 9783527607495. Мұрағатталды түпнұсқасынан 2017-09-08 ж.
- ^ «Жыныстық, инъекциялық есірткіні қолданудан немесе АИТВ-ға кәсіптік емес әсер етуден кейінгі антиретровирустық экспозициядан кейінгі профилактикасы бойынша жаңартылған нұсқаулар - Америка Құрама Штаттары, 2016 ж.» (PDF). Ауруларды бақылау және алдын алу орталығы. Жедел медициналық көмектің жылнамалары. Мұрағатталды (PDF) түпнұсқадан 2016 жылғы 20 қарашада. Алынған 11 тамыз 2016.
- ^ «АИТВ-1 жұқтырған ересектер мен жасөспірімдерде антиретровирустық агенттерді қолдану жөніндегі нұсқаулық» (PDF). Ересектер мен жасөспірімдерге арналған антиретровирустық нұсқаулар панелі, АҚШ денсаулық сақтау және халыққа қызмет көрсету департаменті (HHS). Мұрағатталды (PDF) түпнұсқадан 2016 жылғы 1 қарашада. Алынған 11 тамыз 2016.
- ^ а б c г. e f Бристоль-Майерс Скибб (желтоқсан 2012). «Зерит (ставудин) капсулалары және пероральді ерітіндіге арналған ұнтақ туралы ақпарат» (PDF). Принстон, Ндж. Мұрағатталды (PDF) түпнұсқасынан 2017-01-31.
- ^ Магула, Н; Dedicoat, M (28 қаңтар 2015). «АИТВ-инфекциясын жұқтырған адамдарды емдеуге арналған ставудиннің жоғары дозасына қарсы төмен дозасы». Cochrane жүйелік шолулардың мәліметтер базасы. 1: CD007497. дои:10.1002 / 14651858.CD007497.pub2. PMID 25627012.
- ^ «Жүкті әйелдер, сәбилер мен балалар | Гендерлік | АИТВ топ бойынша | АИТВ / ЖИТС | CDC». www.CDC.gov. Мұрағатталды түпнұсқадан 2016 жылғы 15 қарашада. Алынған 15 қараша 2016.
- ^ «Өнеркәсіпке арналған FDA нұсқаулығы: гериатриялық халық» (PDF). FDA.gov. Мұрағатталды (PDF) түпнұсқадан 2016 жылғы 14 қыркүйекте.
- ^ Wangsomboonsiri W, Mahasirimongkol S, Chantarangsu S және т.б. (15 ақпан, 2010). «HLA-B * 4001 мен ставудині бар антиретровирустық режим алған Таиландтан АИТВ жұқтырған науқастар арасындағы липодистрофия арасындағы қауымдастық». Клиникалық инфекциялық аурулар. 50 (4): 597–604. дои:10.1086/650003. PMID 20073992.
- ^ «Денсаулықты жақсарту, инфекцияларды азайту және өмірді сақтау бойынша АҚТҚ туралы жаңа ұсыныстар». Дүниежүзілік денсаулық сақтау ұйымы. 30 қараша, 2009 ж. Мұрағатталды түпнұсқадан 2010 жылғы 18 қаңтарда.
- ^ «Джером Хорвитц». Telegraph.co.uk. Мұрағатталды түпнұсқасынан 2016-11-07 ж. Алынған 2016-11-06.
- ^ а б Прусофф, Уильям (2001-03-19). «Ғалымның әңгімесі». The New York Times. ISSN 0362-4331. Мұрағатталды түпнұсқасынан 2016-11-07 ж. Алынған 2016-11-06.
- ^ «Ставудинді FDA мақұлдау (d4T) | Жаңалықтар | AIDSinfo». AIDSinfo. Мұрағатталды түпнұсқасынан 2016-11-07 ж. Алынған 2016-11-06.
- ^ АҚШ-тың Азық-түлік және дәрі-дәрмектермен қамтамасыз ету басқармасы 10903 Нью-Гэмпшир авеню Сильвер Спринг, MD 20993 1-888-INFO-FDA (1-888-463-6332). (2018, 30 сәуір). FDA есірткі тапшылығы. 1 мамыр 2018 ж. Бастап алынды https://www.accessdata.fda.gov/scripts/drugshortages/dsp_ActiveIngredientDetails.cfm Есірткінің жетіспеушілігі & AI = Ставудин капсулалары & st = d & tab = tabs-4 & панельдер = 0 & elqTrackId = ea74e0ed22944bcb80c0e85a7812de68 & elq = eba2efb7014449bd94d27eba432bc417 & elqaid = 3343 & 25
Сыртқы сілтемелер
- «Ставудин». Есірткі туралы ақпарат порталы. АҚШ ұлттық медицина кітапханасы.
