Мистикалық фиброз - Cystic fibrosis - Wikipedia
| Мистикалық фиброз | |
|---|---|
| Басқа атаулар | Муковисцидоз |
| Мамандық | Медициналық генетика, пульмонология |
| Белгілері | Тыныс алудың қиындауы, жөтел шырыш, нашар өсу, майлы нәжіс[1] |
| Әдеттегі басталу | Белгілері ~ 6 ай[2] |
| Ұзақтығы | Өмір ұзақ[3] |
| Себептері | Генетикалық Gen-01 (аутосомды-рецессивті )[1] |
| Диагностикалық әдіс | Пот тер, генетикалық тестілеу[1] |
| Емдеу | Антибиотиктер, ұйқы безі ферменттерін ауыстыру, өкпе трансплантациясы[1] |
| Болжам | 42-ден 50 жасқа дейінгі өмір сүру ұзақтығы (дамыған әлем)[4] |
| Жиілік | 3000-нан 1 (Солтүстік Еуропа )[1] |
Мистикалық фиброз (CF) Бұл генетикалық бұзылыс бұл көбіне әсер етеді өкпе, сонымен қатар ұйқы безі, бауыр, бүйрек, және ішек.[1][5] Ұзақ мерзімді мәселелерге мыналар жатады тыныс алудың қиындауы және жөтел шырыш нәтижесінде жиі өкпе инфекциясы.[1] Басқа белгілер және белгілері қамтуы мүмкін синустық инфекциялар, нашар өсу, майлы нәжіс, клубтинг саусақтардың және саусақтардың, және бедеулік ерлердің көпшілігінде.[1] Әр түрлі адамдарда әр түрлі белгілер болуы мүмкін.[1]
CF мұра ретінде беріледі аутосомды-рецессивті мәнер.[1] Бұл екі данада да мутациялардың болуынан туындайды ген үшін цистикалық фиброздың трансмембраналық өткізгіштік реттегіші (CFTR) ақуыз.[1] Бір жұмыс көшірмесі барлар тасымалдаушылар болып табылады, әйтпесе дені сау адамдар.[3] CFTR тер өндірісіне қатысады, ас қорыту сұйықтық және шырыш.[6] CFTR функционалды болмаған кезде, оның орнына әдетте жұқа болып келетін секрециялар қою болады.[7] Ауру диагноз қойылады тер сынағы және генетикалық тестілеу.[1] Сәбилерді туылған кезде скринингтен өткізу әлемнің кейбір аймақтарында өтеді.[1]
Цистозды фиброзды емдеудің белгілі әдісі жоқ.[3] Өкпе инфекциясы емделеді антибиотиктер ішілік, ингаляциялық немесе ауыз арқылы енгізілуі мүмкін.[1] Кейде антибиотик азитромицин ұзақ мерзімді қолданылады.[1] Ингаляция гипертониялық тұзды ерітінді және салбутамол сонымен қатар пайдалы болуы мүмкін.[1] Өкпені трансплантациялау өкпенің қызметі нашарлай берсе, мүмкін нұсқа болуы мүмкін.[1] Ұйқы безінің ферменттерін ауыстыру және майда еритін витамин қоспалар, әсіресе жастарда маңызды.[1] Әуе жолын тазарту техникасы сияқты кеуде физиотерапиясы қысқа мерзімді пайдасы бар, бірақ ұзақ мерзімді әсерлері түсініксіз.[8] Орташа өмір сүру ұзақтығы 42 мен 50 жас аралығында дамыған әлем.[4][9] Өкпенің проблемалары муковисцидозбен ауыратын адамдардың 80% -ында өлімге жауап береді.[1]
CF адамдар арасында жиі кездеседі Солтүстік Еуропа шығу тегі және әр 3000 нәрестенің біреуіне әсер етеді.[1] Шамамен 25 адамның біреуі тасымалдаушы болып табылады.[3] Бұл африкалықтар мен азиялықтарда аз кездеседі.[1] Бұл алдымен белгілі бір ауру ретінде танылды Дороти Андерсен 1938 жылы, шартқа сәйкес келетін сипаттамалармен, кем дегенде, 1595 ж.[5] «Муковисцидоз» атауы сипаттамаға жатады фиброз және кисталар ішіндегі форма ұйқы безі.[5][10]
Белгілері мен белгілері

Цистозды фиброздың негізгі белгілері мен белгілері тұзды-дәмді тері,[11] қалыпты тамақ қабылдауға қарамастан нашар өсу және нашар салмақ қосу,[12] қалың, жабысқақ шырыштың жиналуы,[13] жиі кеудеге инфекциялар, жөтел немесе ентігу.[14] Еркектер болуы мүмкін бедеулік байланысты vas deferens-тің туа біткен болмауы.[15] Симптомдар көбінесе нәресте мен балалық шақта пайда болады, мысалы ішектің бітелуі байланысты меконий ішек жаңа туған нәрестелерде.[16]
Балалар өсіп жатқанда, олар альвеолалардағы шырышты шығару үшін жаттығулар жасайды.[17] Эпителий жасушалары адамда мутацияланған ақуыз бар, ол әдеттен тыс тұтқыр шырыш өндірісіне әкеледі.[13] Балалардың нашар өсуі, әдетте, құрдастарымен бірдей салмақ немесе бой көтеруге қабілетсіздік ретінде көрінеді, ал кейде нашар өсу үшін тергеу басталғанға дейін диагноз қойылмайды. Өсудің себептері көп факторлы болып табылады және оларға созылмалы өкпе инфекциясы, қоректік заттардың асқазан-ішек жолдары арқылы нашар сіңуі және созылмалы аурудың салдарынан метаболикалық қажеттіліктің жоғарылауы жатады.[12]
Сирек жағдайларда муковисцидоз а түрінде көрінуі мүмкін коагуляцияның бұзылуы. К дәрумені сіңіріледі емшек сүті, формула, кейінірек қатты тағамдар. Бұл жұтылу кейбір CF науқастарында нашарлайды. Жас балалар әсіресе К витаминінің малабсорбтивті бұзылуларына сезімтал, өйткені плацентаның өте аз мөлшері ғана плацента арқылы өтеді, сондықтан баланың қоры өте төмен және туылғаннан кейін К витаминін диеталық көздерден сіңіру қабілеті шектеулі. II, VII, IX және X ұю факторлары К витаминіне тәуелді болғандықтан, К витаминінің төмен деңгейі коагуляцияға әкелуі мүмкін. Демек, балада түсініксіз көгерулер болған кезде, негізгі аурудың бар-жоғын анықтау үшін коагуляцияны бағалау қажет болуы мүмкін.[18]
Өкпе және синус

Жасыл = Pseudomonas aeruginosa
Қоңыр = Алтын стафилококк
Көк = Гемофилді тұмау
Қызыл = Burkholderia cepacia күрделі
Өкпе ауруы шырыштың өсуіне байланысты тыныс алу жолдарының бітелуіне, азаюына әкеледі мукоцилиарлы клиренс және нәтижесінде қабыну.[19][20] Қабыну мен инфекция жарақат пен өкпенің құрылымдық өзгерістерін тудырады, бұл әртүрлі белгілерге әкеледі. Алғашқы сатысында тынымсыз жөтел, көп мөлшерде қақырық өндіріс және жаттығу қабілетінің төмендеуі жиі кездеседі. Осы белгілердің көпшілігі қашан пайда болады бактериялар әдетте қалың шырышты мекендейтіндер бақылаусыз өсіп, пневмония тудырады.
Кейінгі кезеңдерде өкпенің архитектурасындағы өзгерістер, мысалы, негізгі тыныс алу жолдарындағы патология (бронхоэктаз ), тыныс алудағы қиындықтарды одан әрі күшейтеді. Басқа белгілерге қанның жөтелуі жатады (гемоптиз ), жоғары қан қысымы өкпеде (өкпе гипертензиясы ), жүрек жетімсіздігі, қиындықтар жеткілікті оттегі денеге (гипоксия сияқты тыныс алу маскаларымен қолдауды қажет ететін тыныс жетіспеушілігі өт жолдарының оң қысымы машиналар немесе желдеткіштер.[21] Алтын стафилококк, Гемофилді тұмау, және Pseudomonas aeruginosa CF науқастарында өкпе инфекциясын қоздыратын ең көп кездесетін үш организм.[20] Ең көп таралған инфекция бактериялық штаммды қамтиды мутация қалыптастыру биофильм - өкпенің мукоидтық штамын қалыптастыру және қолдау эпителий нәтижесінде инфекцияны дамытатын ағынды механизмдер пайда болуы мүмкін.[22] Әдеттегі бактериялық инфекциялардан басқа, CF ауруы бар адамдар өкпенің басқа ауруларын жиі дамытады.
Олардың арасында аллергиялық бронхопульмониялық аспергиллез, онда организмнің жалпыға реакциясы саңырауқұлақ Aspergillus fumigatus тыныс алу проблемаларының нашарлауын тудырады. Тағы біреуі инфекция Mycobacterium avium күрделі, байланысты бактериялар тобы туберкулез, бұл өкпенің зақымдануына әкелуі мүмкін және қарапайым антибиотиктерге жауап бермейді.[23] CF ауруы бар адамдар а пневмоторакс.[24]
Шырыш параназальды синус бірдей қалың және синус өтуінің бітелуіне әкелуі мүмкін, инфекцияға әкелуі мүмкін. Бұл бет аймағында ауырсынуды, безгекті, мұрыннан дренажды және бас ауруы. CF бар адамдарда мұрын тінінің өсуі мүмкін (мұрын полиптері ) созылмалы синусын инфекцияларының қабынуына байланысты.[25] Қайталанатын синоназальды полиптер CF науқастарының 10% -дан 25% -ына дейін болуы мүмкін.[20] Бұл полиптер мұрын жолдарын жауып, тыныс алудың қиындауын арттыруы мүмкін.[26][27]
Кардиореспираторлық асқынулар - АҚШ-тағы көптеген CF орталықтарындағы пациенттерде өлімнің ең көп таралған себептері (шамамен 80%).[20]
Асқазан-ішек
Босанғанға дейін және жаңа туған нәрестелерді скринингтен өткізу, жаңа туылған нәресте нәжісті жібере алмаған кезде муковисцидоз жиі анықталды (меконий ), бұл толығымен блоктауы мүмкін ішектер және ауыр ауру тудыруы мүмкін. Бұл шарт деп аталады меконий ішек, 5-10% кездеседі[20] КФ бар жаңа туылған нәрестелердің Сонымен қатар, ішкі шығыңқы тік ішек мембраналар (ректальды пролапс ) CF бар балалардың 10% -ында жиі кездеседі,[20] және бұл нәжіс көлемінің ұлғаюынан, тамақтанбау, және құрсақ ішілік қысымның жоғарылауы жөтелге байланысты.[28]
Өкпеде байқалатын қалың шырыштың секрециясының қалыңдығы бар ұйқы безі, қамтамасыз етуге жауапты орган ас қорыту шырындары бұл тағамды бұзуға көмектеседі. Бұл секрециялар экзокринді ас қорыту ферменттерінің он екі елі ішек және ұйқы безінің қайтымсыз зақымдануына әкеледі, көбінесе ауырсыну қабынуымен (панкреатит ).[29] The ұйқы безі түтіктері әдетте ересек балаларда немесе жасөспірімдерде байқалатын неғұрлым дамыған жағдайларда қосылады.[20] Бұл экзокринді бездердің атрофиясын және үдемелі фиброзды тудырады.[20]
Ас қорыту ферменттерінің жетіспеушілігі қоректік заттарды олардың кейіннен нәжіспен шығарылуымен қиындық тудырады, бұл бұзылу деп аталады мальабсорбция бұл калорияны жоғалтуға байланысты тамақтанбауға және нашар өсуге және дамуға әкеледі. Нәтиже гипопротеинемия жалпы ісінуді тудыратындай ауыр болуы мүмкін.[20] КФ-мен ауыратын адамдарда майда еритін витаминдерді сіңіру қиынға соғады A, Д., E, және Қ.[30]
Ұйқы безінің проблемаларынан басқа, CF ауруы бар адамдар көбірек тәжірибе алады күйдіргі,[30] ішектің бітелуі инвагинация, және іш қату.[31] CF бар егде жастағы адамдар дамуы мүмкін дистальды ішек өтімсіздігі синдромы қалыңдатылған нәжіс ішектің бітелуіне себеп болған кезде.[30]
Экзокриндік панкреатиялық жеткіліксіздік CF бар науқастардың көпшілігінде (85% -дан 90% -ға дейін) кездеседі.[20] Бұл негізінен «ауыр» CFTR мутациясымен байланысты, мұнда екі аллель де толықтай жұмыс істемейді (мысалы, 50F508 / ΔF508).[20] Бұл CFTR белсенділігі аз болатын немесе екі «жеңіл» CFTR мутациясы бар бір «ауыр» және бір «жұмсақ» CFTR мутациясы бар пациенттердің 10-15% -ында кездеседі.[20] Бұл жұмсақ жағдайларда, ұйқы безінің экзокринді функциясы әлі де бар, сондықтан ферменттерді қосу қажет емес.[20] Әдетте, ұйқы безіне жеткілікті фенотиптерде GI-дің басқа асқынулары болмайды, және тұтастай алғанда, мұндай адамдар әдетте жақсы өседі және дамиды.[20] Осыған қарамастан, идиопатиялық созылмалы панкреатит ұйқы безіне жеткілікті, CF-мен ауыратын адамдарда болуы мүмкін және іштің қайталанатын ауырсынуымен және өмірге қауіп төндіретін асқынулармен байланысты.[20]
Қою секрециялар сонымен қатар CF бар науқастарда бауыр проблемаларын тудыруы мүмкін. Өт Ас қорытуға көмектесу үшін бауыр бөліп шығаратын зат блоктауы мүмкін өт жолдары, бауырдың зақымдануына әкеледі. Липидтердің қорытылуы немесе сіңірілуі нашарлауы мүмкін стеаторея. Уақыт өте келе бұл тыртық пен түйінге әкелуі мүмкін (цирроз ). Бауыр қанды токсиндерден арылта алмайды және жауапты белоктар сияқты маңызды белоктар түзбейді қан ұюы.[32][33] Бауыр ауруы - CF-мен байланысты өлімнің үшінші себебі.[20]
Эндокринді
Ұйқы безінде Лангерган аралдары, жасауға жауапты инсулин, қанды реттеуге көмектесетін гормон глюкоза. Ұйқы безінің зақымдануы арал жасушаларының жоғалуына әкелуі мүмкін, бұл аурумен ауыратындарға ғана тән қант диабетінің түріне әкеледі.[34] Бұл муковисцидозға байланысты қант диабеті табуға болатын сипаттамалармен бөліседі 1 тип және 2 тип қант диабеті, және өкпенің емес негізгі асқынулардың бірі болып табылады.[35]
D дәрумені қатысады кальций және фосфат реттеу. Малабсорбцияға байланысты диетадан Д витаминін нашар қабылдау сүйек ауруына әкелуі мүмкін остеопороз онда әлсіреген сүйектер сезімтал сынықтар.[36] Сонымен қатар, CF ауруы бар адамдар жиі дамиды клубтинг созылмалы аурудың әсерінен олардың саусақтары мен саусақтарының төмен оттегі олардың тіндерінде.[37][38]
Бедеулік
Бедеулік ерлерге де, әйелдерге де әсер етеді. Цистозды фиброзбен ауыратын ерлердің кем дегенде 97% -ы бедеулікке ие, бірақ стерильді емес, сонымен қатар репродуктивті техникасы бар балалар туа алады.[39] CF бар еркектердегі бедеуліктің негізгі себебі болып табылады vas deferens-тің туа біткен болмауы (бұл әдетте байланыстырады аталық бездер дейін эякуляциялық түтіктер туралы пенис ), бірақ ықтимал, сонымен қатар басқа механизмдермен сперматозоидтар жоқ, қалыптан тыс пішінді сперматозоидтар, және аз қозғалмалы сперматозоидтар.[40] Бедеулікті бағалау кезінде тамырлы деферендердің туа біткен жоқтығы анықталған көптеген еркектерде жеңіл, бұрын анықталмаған КФ формасы бар.[41] ЖК-мен ауыратын әйелдердің шамамен 20% -ында жатыр мойны шырышының қалыңдығы немесе тамақтанбау салдарынан туу қабілеттілігі қиын. Ауыр жағдайларда жеткіліксіз тамақтану бұзылады овуляция және себептері етеккірдің жетіспеушілігі.[42]
Себептері
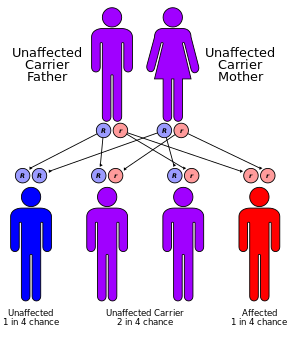
CF мутациясының әсерінен пайда болады ген цистикалық фиброздың трансмембраналық өткізгіштік реттегіші (CFTR). Ең көп таралған мутация, 50F508, жою болып табылады (Δ амин қышқылының жоғалуына әкелетін үш нуклеотидтің жойылуын білдіреді фенилаланин (F) ақуыздағы 508-ші позицияда.[43][44] Бұл мутация үштен екі бөлікті құрайды (66-70%)[20]) бүкіл әлемдегі CF жағдайларының және 90% жағдайлары АҚШ; дегенмен 1500-ден астам мутациялар CF түзе алады.[45] Көптеген адамдарда екі жұмыс көшірмесі (аллель) болса да CFTR ген, тек біреуі муковисцидоздың алдын алу үшін қажет. CF аллель де функционалды CFTR ақуызын жасай алмайтын кезде дамиды. Осылайша, CF ан аутосомды-рецессивті ауру.[46]
The CFTR q31.2 табылған ген локус туралы хромосома 7, 230,000 құрайды негізгі жұптар ұзын және 1480 болатын ақуызды жасайды аминқышқылдары ұзақ. Нақтырақ айтсақ, орналасу 7 -31.2 түрінде көрсетілген 7-хромосоманың 3-аймақ, 1-жолақ, 2-жолақ, 117.120.016 мен 117.308.718 базалық жұбы арасында орналасқан. Құрылымдық тұрғыдан CFTR ретінде белгілі геннің түрі ABC гені. Бұл геннің өнімі (CFTR ақуызы) тер, ас қорыту шырындары мен шырышты түзуде маңызды хлорид-иондық канал болып табылады. Бұл протеин екіге ие ATP-гидролиздеу домендер, бұл ақуызды энергияны түрінде пайдалануға мүмкіндік береді ATP. Ол сондай-ақ алты доменнен тұрады альфа спиралдары ақуыздың жасуша мембранасынан өтуіне мүмкіндік беретін бөлік. Реттеуші байланыстыратын сайт ақуыз бойынша активацияға мүмкіндік береді фосфорлану, негізінен cAMP-тәуелді протеинкиназа.[21] The карбоксил терминалы ақуыздың зәкіріне бекітілген цитоскелет а PDZ домендік өзара әрекеттесу.[47] Өкпе жолдарындағы CFTR-нің көп бөлігі шырыш қасиеттерін реттейтін сирек ион тасымалдайтын жасушалардан түзіледі.[48]
Сонымен қатар, генетикалық модификаторлардың дәлелдері көбейеді CFTR аурудың жиілігін және ауырлығын модуляциялау. Бір мысал маннан байланыстыратын лектин қатысады туа біткен иммунитет жеңілдету арқылы фагоцитоз микроорганизмдер. Полиморфизмдер ақуыздың айналым деңгейінің төмендеуіне алып келетін маннан байланыстыратын лектиндік аллельдердің бірінде немесе екеуінде де өкпенің соңғы сатыдағы ауруының үш есе жоғары қаупі, сонымен қатар созылмалы бактериялық инфекциялардың ауыртпалығы жоғарылайды.[20]
Тасымалдаушылар
Солтүстік Еуропадан шыққан әрбір 25 адамның біреуі а генетикалық тасымалдаушы. Ауру осы тасымалдаушылардың екеуінің балалары болған кезде ғана пайда болады, өйткені олардың арасындағы әр жүктіліктің ауруға шалдыққан баланы дүниеге әкелу мүмкіндігі 25% құрайды. Әр 3000 жаңа туылған нәрестенің біреуінде ғана CF болса да, CF тудыратын геннің 900-ден астам мутациясы белгілі. Ағымдағы тесттер ең көп таралған мутацияны іздейді.[49]
Тест арқылы алынған мутациялар адамның этникалық тобына немесе отбасында CF пайда болуына байланысты өзгереді. 10 миллионнан астам американдықтар, соның ішінде әрбір 25 ақ американдық, CF генінің мутациясының тасымалдаушысы болып табылады. CF басқа нәсілдерде кездеседі, бірақ ақ адамдар сияқты емес. 46 испандық американдықтардың біреуі, 65 африкалық американдықтардың біреуі және азиялық американдықтардың 90-нан біреуі CF генінің мутациясын ұстайды.[49]
Патофизиология


Бірнеше мутация CFTR ген пайда болуы мүмкін, және әртүрлі мутациялар CFTR ақуызында әр түрлі ақауларды тудырады, кейде жеңілірек немесе ауыр аурулар тудырады. Бұл ақуыз ақаулары сонымен қатар кейде өз қызметін қалпына келтіре алатын дәрі-дәрмектерге арналған. 50F508-CFTR, АҚШ-тағы> 90% науқастарда кездеседі, олай болмайтын ақуыз жасайды бүктеу қалыпты жағдайда және жасуша мембранасына тиісті түрде жеткізілмейді, нәтижесінде оның ыдырауы болады.
Басқа мутациялар ақуыздардың тым қысқа болуына әкеледі (кесілген), өйткені өндіріс мерзімінен бұрын аяқталады. Басқа мутациялар энергияны (ATP түрінде) қалыпты түрде пайдаланбайтын, хлорид, иодид және тиоцианаттың мембранадан тиісті түрде өтуіне жол бермейтін ақуыздар түзеді,[50] және әдеттегіден жылдам жылдамдықпен деградацияға ұшырайды. Мутация сонымен қатар CFTR ақуызының аз көшірмесін алуға әкелуі мүмкін.[21]
Осы геннің көмегімен түзілген ақуыз -ге бекітіледі сыртқы мембрана ішіндегі жасушалар тер бездері, өкпе, ұйқы безі және денеде қалған барлық экзокринді бездер. Ақуыз бұл мембрананы қамтиды және а ретінде қызмет етеді арна жасушаның ішкі бөлігін қосатын (цитоплазма ) дейін қоршаған сұйықтық. Бұл канал бірінші кезекте галогендік аниондардың жасушаның ішінен сыртына қарай қозғалуын басқаруға жауап береді; алайда, тер түтіктерінде ол хлоридтің тер түтігінен цитоплазмаға өтуін жеңілдетеді. CFTR ақуызы тер түтіктеріндегі, хлорид пен тиоцианаттағы иондарды сіңірмеген кезде[51] тер бездерінен босатылған түтіктердің ішіне түсіп, теріге айдалады.
Қосымша гипотиоцианит, OSCN, иммундық қорғаныс жүйесі өндіре алмайды.[52][53] Себебі хлорид теріс зарядталған, бұл әдетте тудыратын ұяшықтың ішіндегі және сыртындағы электрлік потенциалды өзгертеді катиондар ұяшыққа өту. Натрий - бұл жасушадан тыс кеңістіктегі ең көп таралған катион. Пот түтіктеріндегі хлоридтің артық мөлшері натрийдің эпителий каналдары арқылы сіңуіне жол бермейді, ал натрий мен хлоридтің қосындысы тұзды түзеді, ол CF бар адамдардың терінде көп мөлшерде жоғалады. Бұл жоғалған тұз терді сынауға негіз болады.[21]
CF-дегі зақымданулардың көп бөлігі зақымдалған органдардың тар жолдарының тығыздалған секрециялармен бітелуіне байланысты. Бұл тосқауылдар өкпені қайта құруға және инфекцияға, ұйқы безіндегі жинақталған ас қорыту ферменттерінің зақымдануына, ішектің қою нәжіспен бітелуіне және т.с.с. әкеледі, ақуыз бен жасуша функциясындағы ақаулардың клиникалық әсерлерді қалай тудыратыны туралы бірнеше теориялар келтірілген. Қазіргі заманғы теория ақаулы иондардың тасымалдануы тыныс алу жолдарының эпителиясындағы дегидратацияға, шырышты қоюлатуға алып келеді деп болжайды. Тыныс алу жолдарының эпителий жасушаларында кірпікшелер жасушаның апикальды беті мен шырышының арасында тыныс алу жолдарының беткі сұйықтығы (ASL) деп аталатын қабатта болады. Иондардың клеткадан және осы қабатқа түсуін CFTR сияқты иондық каналдар анықтайды. CFTR хлор иондарының жасушадан және ASL-ге түсуіне мүмкіндік беріп қана қоймай, сонымен қатар ENac деп аталатын басқа каналды реттейді, бұл натрий иондарының ASL-дан шығып, тыныс алу эпителийіне енуіне мүмкіндік береді. CFTR әдетте бұл арнаны тежейді, бірақ егер CFTR ақаулы болса, онда натрий ASL-ден және жасушаға еркін ағып кетеді.
Су натрийден кейін келе жатқанда, ASL тереңдігі таусылып, кірпікшелер шырышты қабатта қалады.[54] Кірпіктер қалың, тұтқыр ортада тиімді қозғала алмайтындықтан, мукоцилиарлы клиренс жетіспейтіндіктен, шырышты қабат пайда болып, кішкене тыныс алу жолдарын бітеп тастайды.[55] Өкпеде тұтқыр, қоректік заттарға бай шырыштың жиналуы бактериялардың ағзаның иммундық жүйесінен жасырынып, қайталанған респираторлық инфекцияларды тудырады. Ұйқы безі түтігінде және терде тер бездерінде бірдей CFTR ақуыздарының болуы да осы жүйелерде симптомдар тудырады.
Созылмалы инфекциялар
Цистозды фиброзбен ауыратын адамдардың өкпесі жас кезінен бастап колонияланып, бактериялармен жұқтырылады. CF бар адамдар арасында жиі таралатын бұл бактериялар өкпенің кішкене тыныс алу жолдарында жиналатын өзгерген шырышта жақсы дамиды. Бұл шырыш бактериялық микроорганизмдердің пайда болуына әкеледі биофильмдер иммундық жасушалар мен антибиотиктердің енуіне қиын. Тұтқыр секрециялар мен тұрақты респираторлық инфекциялар тыныс алу жолдарын біртіндеп қайта құру арқылы өкпені бірнеше рет зақымдайды, бұл инфекцияны жоюды одан әрі қиындатады.[56] Өкпенің инфекциялық инфекцияларының және тыныс алу жолдарын қайта құрудың табиғи тарихы нашар зерттелген, бұл көбінесе КФ пациенттерінің микробиомдарының ішінде де, олардың арасында да кеңістіктік және уақыттық гетерогенділікке байланысты.[57]
Уақыт өте келе бактериялардың типтері де, олардың жеке ерекшеліктері де CF бар адамдарда өзгереді. Бастапқы кезеңде, мысалы, жалпы бактериялар S. aureus және H. influenzae колонизация және өкпеге инфекция.[20] Сайып келгенде, Pseudomonas aeruginosa (және кейде Burkholderia cepacia ) үстемдік етеді. 18 жасқа дейін КФ классикалық портымен науқастардың 80% P. aeruginosaжәне 3,5% порт B. cepacia.[20] Өкпеге енгеннен кейін бұл бактериялар қоршаған ортаға бейімделіп, дамиды қарсылық жиі қолданылатын антибиотиктерге. Псевдомонас «мукоид» деп аталатын үлкен колониялардың пайда болуына мүмкіндік беретін ерекше сипаттамаларды дамыта алады Псевдомонас, олар CF жоқ адамдарда сирек кездеседі.[56] Ғылыми дәлелдер бұны ұсынады интерлейкин 17 жол кезінде қабыну реакциясының тұрақтылығы мен модуляциясында шешуші рөл атқарады P. aeruginosa CF инфекциясы[58] Атап айтқанда, интерлейкиндік 17-делдалдық иммунитет тыныс алу жолдарының созылмалы инфекциясы кезінде екі жақты белсенділікке ие; бір жағынан, бақылауға ықпал етеді P. aeruginosa ауыртпалық, ал екінші жағынан, күшейтілген өкпе нейтрофилиясын және тіндерді қайта құруды таратады.[58]
Инфекция әр түрлі адамдар арасында CF арқылы өту арқылы таралуы мүмкін.[59] Бұрын КФ-мен ауыратын адамдар жазғы «CF лагерлеріне» және басқа да сауықтыру жиындарына жиі қатысатын.[60][61] Ауруханалар СФ-мен ауыратын науқастарды жалпы қолданылатын жерлерге және әдеттегі жабдықтарға топтастырды (мысалы шашыратқыштар )[62] жеке пациенттер арасында зарарсыздандырылмаған.[63] Бұл пациенттер топтары арасында бактериялардың қауіпті штамдарының таралуына әкелді. Нәтижесінде, қазір денсаулық сақтау жүйесінде КФ ауруы бар адамдар үнемі бір-бірінен оқшауланады, ал медициналық қызмет көрсетушілер вирусты бактериалды штамдардың таралуын шектеу үшін КФ науқастарын тексерген кезде халат пен қолғап киюге шақырылады.[64]
CF пациенттері тыныс алу жолдарын жіп тәрізді саңырауқұлақтармен созылмалы түрде колонизациялауы мүмкін (мысалы Aspergillus fumigatus, Scedosporium apiospermum, Aspergillus terreus ) және / немесе ашытқылар (мысалы Candida albicans ); сирек оқшауланған басқа жіп тәрізді саңырауқұлақтар жатады Aspergillus flavus және Aspergillus nidulans (CF тыныс алу секрецияларында уақытша пайда болады) және Exophiala dermatitidis және Скедоспориум өнімі (созылмалы тыныс алу колонизаторлары); сияқты кейбір жіп тәрізді саңырауқұлақтар Penicillium emersonii және Акрофиалофора фузиспорасы пациенттерде тек қана CF аясында кездеседі.[65] CF сипаттайтын мукоцилиарлық клиренстің ақаулығы жергілікті иммунологиялық бұзылулармен байланысты. Сонымен қатар, антибиотиктермен ұзақ емдеу және кортикостероидты емдеу саңырауқұлақтардың көбеюін жеңілдетуі мүмкін. Саңырауқұлақтармен тыныс алу жолдарын колонизациялаудың клиникалық маңыздылығы әлі де болса да талас тудыратын мәселе болса да, жіп тәрізді саңырауқұлақтар жергілікті қабыну реакциясына ықпал етуі мүмкін, демек өкпенің қызметі біртіндеп нашарлайды, өйткені жиі кездесетін аллергиялық бронхопульмональды аспергиллез - саңырауқұлақ ауруы Th2-негізделген иммундық реакцияны қамтитын CF контексті Аспергиллус түрлері.[65][66]
Диагноз

Цистозды фиброзға диагноз қою көптеген түрлі әдістермен, соның ішінде жаңа туған нәрестелерді скрининг, терді тексеру және генетикалық тестілеу арқылы жүзеге асырылуы мүмкін.[67] 2006 жылдан бастап АҚШ-та жағдайлардың 10% туылғаннан кейін көп ұзамай жаңа туған нәрестелерді скринингтік бағдарламалар шеңберінде диагноз қойылады. Жаңа туған нәресте экраны бастапқыда қан концентрациясын жоғарылатады иммунореактивті трипсиноген.[68] Аномальды жаңа туған нәресте экраны бар сәбилерге CF диагнозын растау үшін терді тексеру қажет.
Көптеген жағдайларда ата-ана диагнозды қояды, себебі нәресте тұзды болады.[20] Иммунореактивті трипсиноген деңгейінің бір мутацияланған көшірмесі бар адамдарда жоғарылауы мүмкін CFTR геннің (тасымалдаушылар) немесе сирек жағдайларда, екі қалыпты көшірмесі бар адамдарда CFTR ген. Осыған байланысты жалған позитивтер, Жаңа туылған нәрестелердегі CF скринингі дау тудыруы мүмкін.[69][70]
АҚШ-тың көптеген штаттары мен елдері туа біткен кезде КФ-ны тексермейді. Сондықтан көптеген адамдарға симптомдардан кейін диагноз қойылады (мысалы, синопульмониялық ауру және GI көріністері)[20]) муковисцидозды бағалауды жеделдету. Тестілеудің ең көп қолданылатын түрі - терді сынау. Терді сынау тершеңдікке әсер ететін дәрілік затты қолдануды қамтиды (пилокарпин ). Дәрілерді тері арқылы беру үшін, ионофорез бір электродты қолданылатын дәрі-дәрмектерге салады және электр тогын терідегі бөлек электродқа жібереді. Алынған терді сүзгі қағазға немесе капиллярлық түтікке жинап, натрий мен хлоридтің қалыптан тыс мөлшеріне талдау жасайды. CF-мен ауыратын адамдар олардың терлерінде олардың мөлшерін арттырды. Керісінше, CF бар адамдарда аз тиоцианат бар гипотиоцианит олардың сілекейінде[71] және шырыш (Банфи және басқалар). CF-нің жұмсақ түрлері кезінде, трансепителиалды потенциалдар айырымы өлшеу пайдалы болуы мүмкін. CF диагнозын CFTR генінің мутациясын анықтау арқылы да анықтауға болады.[72]
CF ауруы бар адамдарды а аурулар тізілімі бұл зерттеушілер мен дәрігерлерге денсаулық нәтижелерін бақылауға және клиникалық зерттеулерге үміткерлерді анықтауға мүмкіндік береді.[73]
Пренатальды
Әйелдер жүкті немесе жүктілікті жоспарлап отырған ерлі-зайыптылар өздерін тестілеуден өткізе алады CFTR олардың генетикалық мутациясы, олардың баласының CF-мен туылу қаупін анықтайды. Әдетте тестілеу алдымен ата-аналардың бірінде немесе екеуінде де жүргізіледі, егер CF қаупі жоғары болса, ұрыққа тестілеу өткізіледі. The Американдық акушер-гинекологтар колледжі жүкті болуды ойлаған барлық адамдарға тасымалдаушы екенін тексеру үшін тексеруден өтуге кеңес береді.[74]
Ұрықта КҚ дамуы әрбір ата-анадан мутацияланған көшірмені беруді талап етеді CFTR ген және CF тестілеуі қымбат болғандықтан, тестілеу көбінесе бастапқыда бір ата-анада жасалады. Егер тестілеу ата-ананың а екенін көрсетсе CFTR гендік мутацияны тасымалдаушы, екінші ата-ана балаларының CF болу қаупін есептеу үшін тексеріледі. CF мыңнан астам әртүрлі мутациялардан туындауы мүмкін.[46] 2016 жылғы жағдай бойынша[жаңарту], әдетте, ең көп таралған мутацияға ғана сыналады, мысалы, ΔF508[46] Коммерциялық қол жетімді тестілердің көпшілігі 32 немесе одан аз түрлі мутацияны іздейді. Егер отбасында сирек кездесетін мутация болса, бұл мутацияға арнайы скринингтік тексеріс жүргізілуі мүмкін. Ағымдағы тестілерде барлық белгілі мутациялар табылмағандықтан, теріс экран баланың CF болмауына кепілдік бермейді.[75]
Жүктілік кезінде тестілеуді плацентаға жүргізуге болады (хорионды вилус сынамалары ) немесе ұрықтың айналасындағы сұйықтық (амниоцентез ). Алайда, хорионикалық вилус сынамалары ұрықтың 100-ден біреуінің, ал амниоцентездің 200-ден біреуінің өлу қаупі бар;[76] жақында жүргізілген зерттеу бұл әлдеқайда төмен болуы мүмкін екенін көрсетті, шамамен 1600-ден біреуі.[77]
Экономикалық тұрғыдан, мукистозды фиброздың жұптары үшін, салыстыру кезінде имплантацияның генетикалық диагнозы (PGD) табиғи тұжырымдамасымен (NC), содан кейін пренатальды тестілеу және зардап шеккен жүктіліктің түсік түсіруімен, PGD 40 жасқа дейінгі ана жасына дейінгі таза экономикалық пайда береді, содан кейін NC, босанғанға дейінгі тестілеу және түсік түсірудің экономикалық тиімділігі жоғары.[78]
Басқару
CF-ті емдеудің белгілі еместігі болғанымен, емдеудің бірнеше әдісі қолданылады. Соңғы 70 жыл ішінде КФ менеджменті айтарлықтай жақсарды. 70 жыл бұрын онымен туылған нәрестелер бірінші жасынан асып кетуі екіталай болса, бүгінгі балалар ересек өмірге дейін жақсы өмір сүруі мүмкін. Кистозды фиброзды емдеудегі соңғы жетістіктер муковисцидозбен ауыратын адамдар өз жағдайларына аз ауыртпалықпен өмір сүре алатындығын білдірді. Басқарудың негізі - бұл емдеудің белсенді әдісі тыныс алу жолдарының инфекциясы және дұрыс тамақтану мен белсенді өмір салтын ынталандыру. Өкпені қалпына келтіру CF-ті басқару адамның өмір бойы жалғасады және ағзаның жұмысын, демек, өмір сүру сапасын арттыруға бағытталған. Ең жақсы жағдайда, қазіргі емдеу ағзалар қызметінің төмендеуін кешіктіреді. Аурудың белгілері әр түрлі болғандықтан, емдеу көбінесе арнайы көпсалалы орталықтарда жүреді және жеке адамға бейімделеді. Терапияның мақсаты - өкпе, асқазан-ішек жолдары (ұйқы безі ферменттерінің қоспаларын қоса), репродуктивті органдар (оның ішінде репродуктивті технология ) және психологиялық қолдау.[68]
CF терапиясының ең дәйекті аспектісі - қою шырыш пен инфекциядан туындаған өкпенің зақымдануын шектеу және емдеу. өмір сапасы. Тамырішілік, деммен жұту, және ішілетін антибиотиктер созылмалы және жедел инфекцияларды емдеу үшін қолданылады. Қою шырышты өзгерту және тазарту үшін механикалық құрылғылар мен ингаляциялық дәрі-дәрмектер қолданылады. Бұл терапия тиімді болғанымен, өте көп уақытты алады. Оттегімен емдеу үйде оттегі деңгейі айтарлықтай төмен адамдарға ұсынылады.[79] Көптеген адамдар CF пайдаланады пробиотиктер олар ішек дисбиозын және қабынуын түзете алады деп ойлайды, бірақ клиникалық зерттеудің дәлелденуі КФ-мен ауыратын адамдардың өкпе өршуін төмендетуге арналған пробиотиктердің тиімділігіне қатысты.[80]
Антибиотиктер
Көптеген адамдар CF-мен бір немесе бірнеше антибиотиктерді, тіпті дені сау болса да, қолданады профилактикалық инфекцияны басу. Антибиотиктер пневмонияға күдік болған кезде немесе өкпенің жұмысының төмендеуі байқалған кезде өте қажет, және оларды әдетте қақырықты талдау нәтижелері мен адамның өткен реакциясы негізінде таңдайды. Бұл ұзаққа созылған терапия жиі ауруханаға жатқызуды және тұрақты емдеуді қажет етеді IV сияқты а перифериялық енгізілген орталық катетер немесе Порт-а-Кат. Сияқты антибиотиктермен ингаляциялық терапия тобрамицин, колистин, және азтреонам көбінесе колонизацияланған бактериялардың көбеюіне кедергі жасау арқылы өкпенің жұмысын жақсарту үшін бірнеше айға беріледі.[81][82][83] Ингаляциялық антибиотикалық терапия инфекциямен күресу арқылы өкпенің жұмысына көмектеседі, сонымен қатар антибиотикке төзімділіктің дамуы, құлақтың шуылы, дауыстың өзгеруі сияқты маңызды кемшіліктер бар.[84] Ингаляция левофлоксацин емдеу үшін қолданылуы мүмкін Pseudomonas aeruginosa инфекцияланған муковисцидозбен ауыратын адамдарда.[85] Pseudomonas aeruginosa инфекциясын ерте басқару оңай және жақсырақ, өйткені антибиотиктермен немесе ішпестен небулизденген антибиотиктерді қолдану оның жойылуын екі жылға дейін сақтай алады.[86] Өкпенің инфекциясы бар КФ науқастарын емдеу үшін антибиотиктерді таңдау кезінде Pseudomonas aeruginosa муковисцидозбен ауыратын адамдарда антибиотиктерді таңдау антибиотиктерді жеке-жеке (бір-бірден) немесе бір-бірімен біріктіріп тестілеу нәтижелеріне негізделуі керек деген түсініксіз.[87]
Антибиотиктер, мысалы, ципрофлоксацин немесе азитромицин инфекцияны болдырмауға немесе жалғасқан инфекцияны бақылауға арналған.[88] The аминогликозид антибиотиктер (мысалы, тобрамицин) қолдануы мүмкін есту қабілетінің төмендеуі, зақымдануы теңгерім жүйесі ішінде ішкі құлақ немесе ұзақ уақыт қолданған кезде бүйрек жеткіліксіздігі.[89] Бұлардың алдын алу үшін жанама әсерлер, қандағы антибиотиктердің мөлшері үнемі өлшенеді және сәйкесінше реттеледі.
Антибиотиктерді қолдануға, аурудың созылмалылығына және төзімді бактериялардың пайда болуына байланысты барлық осы факторлар антибиотик сияқты әртүрлі стратегияларды іздеуді қажет етеді адъювант терапия.[90] Қазіргі уақытта бірде-бір клиникалық зерттеулердің бірде-бір дәлелдемесі антибиотиктердің муковисцидозбен және өкпенің өршуінде тиімділігін көрсетпейді Burkholderia cepacia күрделі[91] немесе емдеу үшін антибиотиктерді қолдану үшін туберкулезден тыс микобактериялар CF бар адамдарда.[92]
Басқа дәрілер
Секрецияны босатуға көмектесетін аэрозолизденген дәрілерге жатады дорназа альфа және гипертониялық тұзды.[93] Dornase - бұл рекомбинантты адам дезоксирибонуклеаз, ол қақырықтағы ДНҚ-ны ыдыратады, осылайша оның тұтқырлығы төмендейді.[94] Dornase альфа өкпенің жұмысын жақсартады және оның өршу қаупін азайтады, бірақ оның басқа ұқсас дәрі-дәрмектерге қарағанда әлдеқайда тиімді екенін білу үшін дәлелдер жеткіліксіз.[95] Денуфозол, тергеу препараты, шырышты сұйылтуға көмектесетін хлоридтің балама арнасын ашады.[96] Ма ингаляциялық кортикостероидтар пайдалы, түсініксіз, бірақ ингаляциялық кортикостероидты терапияны тоқтату қауіпсіз.[97] Кортикостероидты емдеу өсуге кедергі келтіріп, зиян келтіруі мүмкін деген әлсіз дәлелдер бар.[97] Пневмококкты вакцинация 2014 жылға дейін зерттелмеген[жаңарту].[98] 2014 жылғы жағдай бойынша[жаңарту], рандомизацияланған бақылаулы зерттеулерден нақты дәлел жоқ тұмауға қарсы вакцина муковисцидозы бар адамдарға пайдалы.[99]
Ivacaftor - бұл ивакафтордан туындаған CFTR ақуызының жоғарылауына жауап беретін бірқатар ерекше мутацияларға байланысты КФ емдеу үшін ауыз арқылы қабылданатын дәрі.[100][101] Бұл өкпенің жұмысын шамамен 10% жақсартады; дегенмен, 2014 жылдан бастап[жаңарту] бұл қымбат.[100] Бірінші жылы нарықта болған кезде АҚШ-тағы тізім бағасы жылына 300 000 доллардан асады.[100][жаңартуды қажет етеді ] 2015 жылдың шілдесінде АҚШ-тың Азық-түлік және дәрі-дәрмек басқармасы мақұлдады lumacaftor / ivacaftor.[102] 2018 жылы FDA комбинацияны мақұлдады ivacaftor / tezacaftor; өндіруші жылына 292 000 АҚШ долларын құрайтын тізім бағасын жариялады.[103] Тезакафтор CFTR ақуызын жасуша бетіндегі дұрыс орынға ауыстыруға көмектеседі және адамдарды емдеуге арналған F508del мутация.[104]
2019 жылы комбинация elexacaftor / ivacaftor / tezacaftor АҚШ-тағы CF үшін мақұлданды.[105] Мұзды фиброзбен ауыратын науқастардың 90% -ында кездесетін f508del мутациясы барларда қолданылады.[105][106] Сәйкес Цистикалық фиброздың қоры, «бұл дәрі аурудың негізгі себептерін емдеуді ұсына отырып, CF тарихындағы жалғыз үлкен терапевтік жетістік болып табылады, нәтижесінде ақырында CF бар адамдардың 90 пайызына модуляторлы терапия әкелуі мүмкін».[107] Клиникалық сынақта аралас препарат енгізілген қатысушылар өкпенің өршуінің кейін 63% төмендеуін және тер хлориді концентрациясының 41,8 ммоль / л төмендеуін байқады.[108] Цистозды фиброзға байланысты симптомдардың репертуарын жеңілдету арқылы біріктірілген препарат аурумен ауыратын науқастар арасында да өмір сапасының көрсеткіштерін едәуір жақсартты.[108][107] Біріктірілген препарат өзара әрекеттесетіні де белгілі CYP3A индукторлары мысалы, элексафафтордың / ивакафтордың / тезакафтордың ағзада концентрациясының төмендеуімен айналуын тудыратын биполярлық бұзылуды емдеуде қолданылатын карбамазепин сияқты. Осылайша, бір мезгілде қолдану ұсынылмайды.[109] АҚШ-тағы тізім бағасы жылына $ 311,000 құрайды;[110] дегенмен, сақтандыру дәрі-дәрмектің көптеген шығындарын жабуы мүмкін.[111]
Урсодезоксихол қышқылы, а өт тұзы, қолданылған, бірақ оның тиімді екендігін көрсететін мәліметтер жеткіліксіз.[112]
Қосымша
Бұл белгісіз А дәрумені немесе бета-каротин қоспалар А дәруменінің жетіспеушілігінен туындаған көз және тері проблемаларына кез-келген әсер етеді.[113]
Цистозды фиброзбен ауыратын адамдардың алдын алатыны туралы нақты дәлел жоқ остеопороз олардың тұтынуын арттыру арқылы D дәрумені.[114]
Адамдарға арналған Е дәрумені deficiency and cystic fibrosis, there is evidence that vitamin E supplementation may improve vitamin E levels, although it is still uncertain what effect supplementation has on vitamin E‐specific deficiency disorders or on lung function.[115]
Robust evidence regarding the effects of К дәрумені supplementation in people with cystic fibrosis is lacking as of 2020.[116]
Various studies have examined the effects of omega-3 fatty acid supplementation for people with cystic fibrosis but the evidence is uncertain whether it has any benefits or adverse effects.[117]
Процедуралар
Several mechanical techniques are used to dislodge sputum and encourage its expectoration. One technique good for short-term airway clearance is chest physiotherapy where a respiratory therapist percusses an individual's chest by hand several times a day, to loosen up secretions. This "percussive effect" can be administered also through specific devices that use chest wall oscillation немесе intrapulmonary percussive ventilator. Other methods such as biphasic cuirass ventilation, and associated clearance mode available in such devices, integrate a cough assistance phase, as well as a vibration phase for dislodging secretions. These are portable and adapted for home use.[8]
Another technique is positive expiratory pressure physiotherapy that consists of providing a back pressure to the airways during expiration. This effect is provided by devices that consists of a mask or a mouthpiece in which a resistance is applied only on the expiration phase.[118] Operating principles of this technique seems to be the increase of gas pressure behind mucus through collateral ventilation along with a temporary increase in functional residual capacity preventing the early collapse of small airways during exhalation.[119][120]
As lung disease worsens, mechanical breathing support may become necessary. Individuals with CF may need to wear special masks at night to help push air into their lungs. These machines, known as bilevel positive airway pressure (BiPAP) ventilators, help prevent low blood oxygen levels during sleep. Non-invasive ventilators may be used during physical therapy to improve sputum clearance.[121] It is not known if this type of therapy has an impact on pulmonary exacerbations or disease progression.[121] It is not known what role non-invasive ventilation therapy has for improving exercise capacity in people with cystic fibrosis.[121] However, the authors noted that "non‐invasive ventilation may be a useful adjunct to other airway clearance techniques, particularly in people with cystic fibrosis who have difficulty expectorating sputum."[122] During severe illness, a tube may be placed in the throat (a procedure known as a трахеостомия ) to enable breathing supported by a ventilator.[123][дәйексөз қажет ]
For children, preliminary studies show массаж терапиясы may help people and their families' quality of life.[124]
Some lung infections require surgical removal of the infected part of the lung. If this is necessary many times, lung function is severely reduced.[125] The most effective treatment options for people with CF who have spontaneous or recurrent пневмоторактар анық емес.[24]
Трансплантация
Lung transplantation may become necessary for individuals with CF as lung function and exercise tolerance decline. Although single lung transplantation is possible in other diseases, individuals with CF must have both lungs replaced because the remaining lung might contain bacteria that could infect the transplanted lung. A pancreatic or liver transplant may be performed at the same time to alleviate liver disease and/or diabetes.[126] Lung transplantation is considered when lung function declines to the point where assistance from mechanical devices is required or someone's survival is threatened.[127] Сәйкес Merck нұсқаулығы, "bilateral lung transplantation for severe lung disease is becoming more routine and more successful with experience and improved techniques. Among adults with CF, median survival posttransplant is about 9 years."[128]
Басқа аспектілер

Newborns with intestinal obstruction typically require surgery, whereas adults with distal intestinal obstruction syndrome typically do not. Treatment of pancreatic insufficiency by replacement of missing digestive enzymes allows the duodenum to properly absorb nutrients and vitamins that would otherwise be lost in the feces. However, the best dosage and form of pancreatic enzyme replacement is unclear, as are the risks and long-term effectiveness of this treatment.[129]
So far, no large-scale research involving the incidence of атеросклероз және жүректің ишемиялық ауруы in adults with cystic fibrosis has been conducted. This is likely because the vast majority of people with cystic fibrosis do not live long enough to develop clinically significant atherosclerosis or coronary heart disease.
Қант диабеті is the most common nonpulmonary complication of CF. It mixes features of type 1 and type 2 diabetes, and is recognized as a distinct entity, cystic fibrosis-related diabetes.[35][130] While oral antidiabetic drugs are sometimes used, the recommended treatment is the use of инсулин injections or an инсулин сорғысы,[131][132] and, unlike in type 1 and 2 diabetes, dietary restrictions are not recommended.[35] Әзірге Stenotrophomonas maltophilia is relatively common in people with cystic fibrosis, the evidence about the effectiveness of antibiotics for S. maltophilia белгісіз.[133]
Бисфосфонаттар taken by mouth or ішілік can be used to improve the bone mineral density in people with cystic fibrosis.[134] When taking bisphosphates intravenously, жағымсыз әсерлер such as pain and flu-like symptoms can be an issue.[134] The adverse effects of bisphosphates taken by mouth on the gastrointestinal tract are not known.[134]
Poor growth may be avoided by insertion of a тамақтандыратын түтік for increasing food energy through supplemental feeds or by administration of injected өсу гормоны.[135]
Sinus infections are treated by prolonged courses of antibiotics. The development of nasal polyps or other chronic changes within the nasal passages may severely limit airflow through the nose, and over time reduce the person's sense of smell. Sinus surgery is often used to alleviate nasal obstruction and to limit further infections. Nasal steroids such as флутиказон пропионаты are used to decrease nasal inflammation.[136]
Female infertility may be overcome by көмекші көбею technology, particularly эмбриондарды ауыстыру техникасы. Male infertility caused by absence of the vas deferens may be overcome with testicular sperm extraction, collecting sperm cells directly from the testicles. If the collected sample contains too few sperm cells to likely have a spontaneous fertilization, интрацитоплазмалық ұрық инъекциясы can be performed.[137] Third party reproduction is also a possibility for women with CF. Whether taking антиоксиданттар affects outcomes is unclear.[138]
Physical exercise is usually part of outpatient care for people with cystic fibrosis.[139] Aerobic exercise seems to be beneficial for aerobic exercise capacity, lung function and health-related quality of life; however, the quality of the evidence was poor.[139]
Due to the use of aminoglycoside antibiotics, ototoxicity is common. Symptoms may include “tinnitus, hearing loss, hyperacusis, aural fullness, dizziness, and vertigo”.[140]
Болжам
The prognosis for cystic fibrosis has improved due to earlier diagnosis through screening and better treatment and access to health care. In 1959, the median age of survival of children with CF in the United States was six months.[141]In 2010, survival is estimated to be 37 years for women and 40 for men.[142] In Canada, median survival increased from 24 years in 1982 to 47.7 in 2007.[143] In the United States those born with CF in 2016 have an expected life expectancy of 47.7 when cared for in specialty clinics.[144]
In the US, of those with CF who are more than 18 years old as of 2009, 92% had graduated from high school, 67% had at least some college education, 15% were disabled, 9% were unemployed, 56% were single, and 39% were married or living with a partner.[145]
Өмір сапасы
Chronic illnesses can be difficult to manage. CF is a chronic illness that affects the "digestive and respiratory tracts resulting in generalized malnutrition and chronic respiratory infections".[146] The thick secretions clog the airways in the lungs, which often cause inflammation and severe lung infections.[147][148] If it is compromised, it affects the quality of life of someone with CF and their ability to complete such tasks as everyday chores.
According to Schmitz and Goldbeck (2006), CF significantly increases emotional stress on both the individual and the family, "and the necessary time-consuming daily treatment routine may have further negative effects on quality of life".[149] However, Havermans and colleagues (2006) have established that young outpatients with CF who have participated in the Cystic Fibrosis Questionnaire-Revised "rated some quality of life domains higher than did their parents".[150] Consequently, outpatients with CF have a more positive outlook for themselves. Қалай Merck нұсқаулығы notes, "with appropriate support, most patients can make an age-appropriate adjustment at home and school. Despite myriad problems, the educational, occupational, and marital successes of patients are impressive."[128]
Furthermore, there are many ways to enhance the quality of life in CF patients. Exercise is promoted to increase lung function. Integrating an exercise regimen into the CF patient's daily routine can significantly improve quality of life.[151] No definitive cure for CF is known, but diverse medications are used, such as mucolytics, bronchodilators, steroids, and antibiotics, that have the purpose of loosening mucus, expanding airways, decreasing inflammation, and fighting lung infections, respectively.[152]
Эпидемиология
| Мутация | Жиілік бүкіл әлемде[153] |
|---|---|
| ΔF508 | 66%–70%[20] |
| G542X | 2.4% |
| G551D | 1.6% |
| N1303K | 1.3% |
| W1282X | 1.2% |
| Басқалары | 27.5% |
Cystic fibrosis is the most common life-limiting autosomal recessive disease among people of European heritage.[154] In the United States, about 30,000 individuals have CF; most are diagnosed by six months of age. In Canada, about 4,000 people have CF.[155] Around 1 in 25 people of European descent, and one in 30 of white Americans,[156] is a carrier of a CF mutation. Although CF is less common in these groups, roughly one in 46 Испандықтар, one in 65 Африкалықтар, and one in 90 Азиялықтар carry at least one abnormal CFTR ген.[157][158] Ireland has the world's highest prevalence of CF, at one in 1353.[159]
Although technically a rare disease, CF is ranked as one of the most widespread life-shortening genetic diseases. It is most common among nations in the Western world. Ерекшелік Финляндия, where only one in 80 people carries a CF mutation.[160] The Дүниежүзілік денсаулық сақтау ұйымы states, "In the European Union, one in 2000–3000 newborns is found to be affected by CF".[161] In the United States, one in 3,500 children is born with CF.[162] In 1997, about one in 3,300 white children in the United States was born with CF. In contrast, only one in 15,000 African American children suffered from it, and in Asian Americans, the rate was even lower at one in 32,000.[163]
Cystic fibrosis is diagnosed equally in males and females. For reasons that remain unclear, data have shown that males tend to have a longer life expectancy than females,[164][165] though recent studies suggest this gender gap may no longer exist, perhaps due to improvements in health care facilities.[166][167] A recent study from Ireland identified a link between the female hormone estrogen and worse outcomes in CF.[168]
The distribution of CF alleles varies among populations. The frequency of ΔF508 carriers has been estimated at one in 200 in northern Sweden, one in 143 in Lithuanians, and one in 38 in Denmark. No ΔF508 carriers were found among 171 Finns and 151 Саамдықтар.[169] ΔF508 does occur in Finland, but it is a minority allele there. CF is known to occur in only 20 families (pedigrees) in Finland.[170]
Эволюция
The ΔF508 mutation is estimated to be up to 52,000 years old.[171] Numerous hypotheses have been advanced as to why such a lethal mutation has persisted and spread in the human population. Other common autosomal recessive diseases such as орақ тәрізді жасушалы анемия have been found to protect carriers from other diseases, an evolutionary trade-off ретінде белгілі гетерозиготаның артықшылығы. Resistance to the following have all been proposed as possible sources of heterozygote advantage:
- Холера: With the discovery that тырысқақ токсині requires normal host CFTR proteins to function properly, it was hypothesized that carriers of mutant CFTR genes benefited from resistance to cholera and other causes of diarrhea.[172][173] Further studies have not confirmed this hypothesis.[174][175]
- Іш сүзегі: Normal CFTR proteins are also essential for the entry of Сальмонелла Typhi into cells,[176] suggesting that carriers of mutant CFTR genes might be resistant to іш сүзегі. Жоқ in vivo study has yet confirmed this. In both cases, the low level of cystic fibrosis outside of Europe, in places where both cholera and typhoid fever are эндемикалық, is not immediately explicable.
- Диарея: The prevalence of CF in Europe might be connected with the development of cattle domestication. In this hypothesis, carriers of a single mutant CFTR had some protection from diarrhea caused by лактозаға төзбеушілік, before the mutations that created lactose tolerance appeared.[177]
- Туберкулез: Another possible explanation is that carriers of the gene could have some resistance to tuberculosis.[178][179] This hypothesis is based on the thesis that CFTR gene mutation carriers have insufficient action in one of their enzymes – arylsulphatase - which is necessary for Туберкулез микобактериясы вируленттілік. Қалай Туберкулез would use its host's sources to affect the individual, and due to the lack of enzyme it could not presents its virulence, being a carrier of CFTR mutation could provide resistance against tuberculosis.[180]
Тарих

CF is supposed to have appeared about 3,000 BC because of migration of peoples, gene mutations, and new conditions in nourishment.[181] Although the entire clinical spectrum of CF was not recognized until the 1930s, certain aspects of CF were identified much earlier. Indeed, literature from Germany and Switzerland in the 18th century warned "Wehe dem Kind, das beim Kuß auf die Stirn salzig schmeckt, es ist verhext und muss bald sterben" or "Woe to the child who tastes salty from a kiss on the brow, for he is cursed and soon must die", recognizing the association between the salt loss in CF and illness.[181]
19 ғасырда, Карл фон Рокитанский described a case of fetal death with меконий перитониті, a complication of meconium ileus associated with CF. Meconium ileus was first described in 1905 by Карл Ландштейнер.[181] 1936 жылы, Guido Fanconi described a connection between целиакия ауруы, cystic fibrosis of the pancreas, and бронхоэктаз.[182]
1938 жылы Дороти Хансин Андерсен published an article, "Cystic Fibrosis of the Pancreas and Its Relation to Celiac Disease: a Clinical and Pathological Study", in the Американдық балалар аурулары журналы. She was the first to describe the characteristic cystic fibrosis of the pancreas and to correlate it with the lung and intestinal disease prominent in CF.[10] She also first hypothesized that CF was a recessive disease and first used pancreatic enzyme replacement to treat affected children. In 1952, Paul di Sant'Agnese discovered abnormalities in sweat electrolytes; a sweat test was developed and improved over the next decade.[183]
The first linkage between CF and another marker (Paroxonase) was found in 1985 by Hans Eiberg, indicating that only one locus exists for CF. In 1988, the first mutation for CF, ΔF508 арқылы ашылды Фрэнсис Коллинз, Лап-Чи Цуй, және Джон Р.Риордан on the seventh chromosome. Subsequent research has found over 1,000 different mutations that cause CF.
Because mutations in the CFTR gene are typically small, классикалық генетика techniques had been unable to accurately pinpoint the mutated gene.[184] Using protein markers, gene-linkage studies were able to map the mutation to chromosome 7. Хромосомалармен жүру және chromosome jumping techniques were then used to identify and жүйелі the gene.[185] In 1989, Lap-Chee Tsui led a team of researchers at the Ауру балаларға арналған аурухана жылы Торонто that discovered the gene responsible for CF. CF represents a classic example of how a human genetic disorder was elucidated strictly by the process of forward genetics.
Зерттеу
Генотерапия
Генотерапия has been explored as a potential cure for CF. Results from clinical trials have shown limited success as of 2016[жаңарту], and using gene therapy as routine therapy is not suggested.[186] A small study published in 2015 found a small benefit.[187]
The focus of much CF gene therapy research is aimed at trying to place a normal copy of the CFTR gene into affected cells. Transferring the normal CFTR gene into the affected epithelium cells would result in the production of functional CFTR protein in all target cells, without adverse reactions or an inflammation response. To prevent the lung manifestations of CF, only 5–10% the normal amount of CFTR gene expression is needed.[188] Multiple approaches have been tested for gene transfer, such as liposomes and viral vectors in animal models and clinical trials. However, both methods were found to be relatively inefficient treatment options,[189] mainly because very few cells take up the vector and express the gene, so the treatment has little effect. Additionally, problems have been noted in cDNA recombination, such that the gene introduced by the treatment is rendered unusable.[190] There has been a functional repair in culture of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients.[191]
Фаготерапия
Фаготерапия is being studied for multidrug resistant bacteria in people with CF.[192][193]
Gene modulators
A number of small molecules that aim at compensating various mutations of the CFTR gene are under development. CFTR modulator therapies have been used in place of other types of genetic therapies. These therapies focus on the expression of a genetic mutation instead of the mutated gene itself. Modulators are split into two classes: potentiators and correctors. Potentiators act on the CFTR ion channels that are embedded in the cell membrane, and these types of drugs help open up the channel to allow transmembrane flow. Correctors are meant to assist in the transportation of nascent proteins, a protein that is formed by ribosomes before it is morphed into a specific shape, to the cell surface to be implemented into the cell membrane.[194]
Most target the transcription stage of genetic expression. One approach has been to try and develop medication that get the ribosome to overcome the кодонды тоқтату and produce a full-length CFTR protein. About 10% of CF results from a premature stop codon in the DNA, leading to early termination of protein synthesis and truncated proteins. These drugs target мағынасыз мутациялар such as G542X, which consists of the amino acid глицин in position 542 being replaced by a stop codon. Aminoglycoside antibiotics interfere with protein synthesis and error-correction. In some cases, they can cause the cell to overcome a premature stop codon by inserting a random amino acid, thereby allowing expression of a full-length protein. Future research for these modulators is focused on the cellular targets that can be effected by a change in a gene's expression. Otherwise, genetic therapy will be used as a treatment when modulator therapies do not work given that 10% of people with cystic fibrosis are not affected by these drugs.[195]
Elexacaftor/ivacaftor/tezacaftor was approved in the United States in 2019 for cystic fibrosis.[196] This combination of previously developed medicines is able to treat up to 90% of people with cystic fibrosis.[194][196] This medications restores some effectiveness of the CFTR protein so that it can work as an ion channel on the cell's surface.[197]
Ecological Therapy
It has previously been shown that inter-species interactions are an important contributor to the pathology of CF lung infections. Examples include the production of antibiotic degrading enzymes such as β-lactamases and the production of metabolic by-products such as short-chain fatty acids (SCFAs) by anaerobic species, which can enhance the pathogenicity of traditional pathogens such as Pseudomonas aeruginosa.[198] Due to this, it has been suggested that the direct alteration of CF microbial community composition and metabolic function would provide an alternative to traditional antibiotic therapies.[57]
Қоғам және мәдениет
- Sick: The Life and Death of Bob Flanagan, Supermasochist, a 1997 documentary film
- 65_Redroses, a 2009 documentary film
- Breathing for a Living, a memoir by Laura Rothenberg
- Every Breath I Take, Surviving and Thriving With Cystic Fibrosis, кітап Claire Wineland
- Бес фут бөлек, a 2019 romantic drama film starring Cole Sprouse және Хейли Лу Ричардсон
- Orla Tinsley: Warrior, a 2018 documentary film about CF campaigner Orla Tinsley
- The орындаушылық өнер туралы Мартин О'Брайен
Әдебиеттер тізімі
- ^ а б c г. e f ж сағ мен j к л м n o б q р с т сен O'Sullivan BP, Freedman SD (May 2009). "Cystic fibrosis". Лансет. 373 (9678): 1891–904. дои:10.1016/s0140-6736(09)60327-5. PMID 19403164. S2CID 46011502.
- ^ Allen JL, Panitch HB, Rubenstein RC (2016). Мистикалық фиброз. CRC Press. б. 92. ISBN 9781439801826. Мұрағатталды түпнұсқасынан 2017-09-08 ж.
- ^ а б c г. Massie J, Delatycki MB (December 2013). "Cystic fibrosis carrier screening". Педиатриялық тыныс алу туралы шолулар. 14 (4): 270–5. дои:10.1016/j.prrv.2012.12.002. PMID 23466339.
- ^ а б Ong T, Ramsey BW (September 2015). "Update in Cystic Fibrosis 2014". Американдық тыныс алу және сыни медициналық көмек журналы. 192 (6): 669–75. дои:10.1164/rccm.201504-0656UP. PMID 26371812.
- ^ а б c Hodson M, Geddes D, Bush A, eds. (2012). Мистикалық фиброз (3-ші басылым). Лондон: Ходер Арнольд. б. 3. ISBN 978-1-4441-1369-3. Мұрағатталды түпнұсқадан 2017 жылғы 8 қыркүйекте.
- ^ Buckingham L (2012). Molecular Diagnostics: Fundamentals, Methods and Clinical Applications (2-ші басылым). Philadelphia: F.A. Davis Co. p. 351. ISBN 978-0-8036-2975-2. Мұрағатталды түпнұсқадан 2017 жылғы 8 қыркүйекте.
- ^ Yankaskas JR, Marshall BC, Sufian B, Simon RH, Rodman D (January 2004). "Cystic fibrosis adult care: consensus conference report". Кеуде. 125 (1 Suppl): 1S–39S. CiteSeerX 10.1.1.562.1904. дои:10.1378/chest.125.1_suppl.1S. PMID 14734689.
- ^ а б Warnock L, Gates A (December 2015). "Chest physiotherapy compared to no chest physiotherapy for cystic fibrosis". Cochrane жүйелік шолулардың мәліметтер базасы (12): CD001401. дои:10.1002/14651858.CD001401.pub3. PMC 6768986. PMID 26688006.
- ^ Nazareth D, Walshaw M (October 2013). "Coming of age in cystic fibrosis - transition from paediatric to adult care". Клиникалық медицина. 13 (5): 482–6. дои:10.7861/clinmedicine.13-5-482. PMC 4953800. PMID 24115706.
- ^ а б Andersen DH (1938). "Cystic fibrosis of the pancreas and its relation to celiac disease: a clinical and pathological study". Am. J. Dis. Бала. 56 (2): 344–99. дои:10.1001/archpedi.1938.01980140114013.
- ^ Quinton PM (June 2007). "Cystic fibrosis: lessons from the sweat gland". Физиология. 22 (3): 212–25. дои:10.1152/physiol.00041.2006. PMID 17557942. S2CID 7921681.
- ^ а б Hardin DS (August 2004). "GH improves growth and clinical status in children with cystic fibrosis -- a review of published studies". Еуропалық эндокринология журналы. 151 Suppl 1 (Suppl 1): S81-5. дои:10.1530/eje.0.151S081. PMID 15339250.
- ^ а б De Lisle RC (September 2009). "Pass the bicarb: the importance of HCO3- for mucin release". Клиникалық тергеу журналы. 119 (9): 2535–7. дои:10.1172/JCI40598. PMC 2735941. PMID 19726878.
- ^ O'Malley CA (May 2009). "Infection control in cystic fibrosis: cohorting, cross-contamination, and the respiratory therapist" (PDF). Тыныс алу қызметі. 54 (5): 641–57. дои:10.4187/aarc0446. PMID 19393108. Мұрағатталды (PDF) from the original on 15 July 2011.
- ^ Makker K, Agarwal A, Sharma R (April 2009). "Oxidative stress & male infertility" (PDF). Үндістанның медициналық зерттеулер журналы. 129 (4): 357–67. PMID 19535829. Архивтелген түпнұсқа (PDF) 5 шілде 2010 ж. Алынған 10 сәуір 2010.
- ^ Blackman SM, Deering-Brose R, McWilliams R, Naughton K, Coleman B, Lai T, et al. (Қазан 2006). "Relative contribution of genetic and nongenetic modifiers to intestinal obstruction in cystic fibrosis". Гастроэнтерология. 131 (4): 1030–9. дои:10.1053/j.gastro.2006.07.016. PMC 1764617. PMID 17030173.
- ^ Ratjen FA (May 2009). "Cystic fibrosis: pathogenesis and future treatment strategies" (PDF). Тыныс алу қызметі. 54 (5): 595–605. дои:10.4187/aarc0427. PMID 19393104. Мұрағатталды (PDF) from the original on 15 July 2011.
- ^ Reaves J, Wallace G (2010). "Unexplained bruising: weighing the pros and cons of possible causes". Consultant for Pediatricians. 9: 201–2.
- ^ "Cystic Fibrosis Pulmonary Guidelines: Pulmonary Complications: Hemoptysis and Pneumthorax". Am. Дж. Респир. Крит. Care Med. 182 (3): 298–306. 2010. дои:10.1164/rccm.201002-0157OC. PMID 20299528.
- ^ а б c г. e f ж сағ мен j к л м n o б q р с т сен v w Mitchell RS, Kumar V, Robbins SL, et al. (2007). Роббинстің негізгі патологиясы. Сондерс / Эльзевье. ISBN 978-1-4160-2973-1.
- ^ а б c г. Rowe SM, Miller S, Sorscher EJ (May 2005). "Cystic fibrosis". Жаңа Англия медицинасы журналы. 352 (19): 1992–2001. дои:10.1056/NEJMra043184. PMID 15888700.
- ^ Johnson PA (2019). "Novel understandings of host cell mechanisms involved in chronic lung infection: Pseudomonas aeruginosa in the cystic fibrotic lung". Journal of Infection and Public Health. 12 (2): 242–246. дои:10.1016/j.jiph.2018.10.014. PMID 30459101.
- ^ Girón RM, Domingo D, Buendía B, Antón E, Ruiz-Velasco LM, Ancochea J (October 2005). "[Nontuberculous mycobacteria in patients with cystic fibrosis]". Archivos de Bronconeumologia (Испанша). 41 (10): 560–5. дои:10.1016/S1579-2129(06)60283-8. PMID 16266669.
- ^ а б Amin R, Noone PG, Ratjen F (December 2012). "Chemical pleurodesis versus surgical intervention for persistent and recurrent pneumothoraces in cystic fibrosis". Cochrane жүйелік шолулардың мәліметтер базасы. 12: CD007481. дои:10.1002/14651858.CD007481.pub3. PMC 7208277. PMID 23235645.
- ^ Franco LP, Camargos PA, Becker HM, Guimarães RE (2009). "Nasal endoscopic evaluation of children and adolescents with cystic fibrosis". Brazilian Journal of Otorhinolaryngology. 75 (6): 806–13. дои:10.1590/S1808-86942009000600006. PMID 20209279.
- ^ Maldonado M, Martínez A, Alobid I, Mullol J (December 2004). "The antrochoanal polyp". Ринология. 42 (4): 178–82. PMID 15626248.
- ^ Ramsey B, Richardson MA (September 1992). "Impact of sinusitis in cystic fibrosis". Аллергия және клиникалық иммунология журналы. 90 (3 Pt 2): 547–52. дои:10.1016/0091-6749(92)90183-3. PMID 1527348.
- ^ Kulczycki LL, Shwachman H (August 1958). "Studies in cystic fibrosis of the pancreas; occurrence of rectal prolapse". Жаңа Англия медицинасы журналы. 259 (9): 409–12. дои:10.1056/NEJM195808282590901. PMID 13578072.
- ^ Cohn JA, Friedman KJ, Noone PG, Knowles MR, Silverman LM, Jowell PS (September 1998). "Relation between mutations of the cystic fibrosis gene and idiopathic pancreatitis". Жаңа Англия медицинасы журналы. 339 (10): 653–8. дои:10.1056/NEJM199809033391002. PMID 9725922.
- ^ а б c Assis DN, Freedman SD (March 2016). "Gastrointestinal Disorders in Cystic Fibrosis". Clinics in Chest Medicine (Шолу). 37 (1): 109–18. дои:10.1016/j.ccm.2015.11.004. PMID 26857772.
- ^ Malfroot A, Dab I (November 1991). "New insights on gastro-oesophageal reflux in cystic fibrosis by longitudinal follow up". Балалық шақтың аурулары архиві. 66 (11): 1339–45. дои:10.1136/adc.66.11.1339. PMC 1793275. PMID 1755649.
- ^ Williams SG, Westaby D, Tanner MS, Mowat AP (October 1992). "Liver and biliary problems in cystic fibrosis". Британдық медициналық бюллетень. 48 (4): 877–92. дои:10.1093/oxfordjournals.bmb.a072583. PMID 1458306.
- ^ Colombo C, Russo MC, Zazzeron L, Romano G (July 2006). "Liver disease in cystic fibrosis". Педиатриялық гастроэнтерология және тамақтану журналы. 43 Suppl 1 (Suppl 1): S49-55. дои:10.1097/01.mpg.0000226390.02355.52. PMID 16819402. S2CID 27836468.
- ^ Moran A, Pyzdrowski KL, Weinreb J, Kahn BB, Smith SA, Adams KS, Seaquist ER (August 1994). "Insulin sensitivity in cystic fibrosis". Қант диабеті. 43 (8): 1020–6. дои:10.2337/diabetes.43.8.1020. PMID 8039595.
- ^ а б c de Aragão Dantas Alves C, Aguiar RA, Alves AC, Santana MA (2007). "Diabetes mellitus in patients with cystic fibrosis". Jornal Brasileiro De Pneumologia. 33 (2): 213–21. дои:10.1590/S1806-37132007000200017. PMID 17724542.
- ^ Haworth CS, Selby PL, Webb AK, Dodd ME, Musson H, McL Niven R, et al. (Қараша 1999). "Low bone mineral density in adults with cystic fibrosis". Торакс. 54 (11): 961–7. дои:10.1136/thx.54.11.961. PMC 1745400. PMID 10525552.
- ^ Vandemergel X, Decaux G (April 2003). "[Review on hypertrophic osteoarthropathy and digital clubbing]". Revical Médicale de Bruxelles (француз тілінде). 24 (2): 88–94. PMID 12806875.
- ^ Pitts-Tucker TJ, Miller MG, Littlewood JM (June 1986). "Finger clubbing in cystic fibrosis". Балалық шақтың аурулары архиві. 61 (6): 576–9. дои:10.1136/adc.61.6.576. PMC 1777828. PMID 3488032.
- ^ McCallum TJ, Milunsky JM, Cunningham DL, Harris DH, Maher TA, Oates RD (October 2000). "Fertility in men with cystic fibrosis: an update on current surgical practices and outcomes". Кеуде. 118 (4): 1059–62. дои:10.1378/chest.118.4.1059. PMID 11035677.
- ^ Chen H, Ruan YC, Xu WM, Chen J, Chan HC (2012). "Regulation of male fertility by CFTR and implications in male infertility". Адамның көбеюі туралы жаңарту. 18 (6): 703–13. дои:10.1093/humupd/dms027. PMID 22709980.
- ^ Augarten A, Yahav Y, Kerem BS, Halle D, Laufer J, Szeinberg A, et al. (Қараша 1994). "Congenital bilateral absence of vas deferens in the absence of cystic fibrosis". Лансет. 344 (8935): 1473–4. дои:10.1016/S0140-6736(94)90292-5. PMID 7968122. S2CID 28860665.
- ^ Gilljam M, Antoniou M, Shin J, Dupuis A, Corey M, Tullis DE (July 2000). "Pregnancy in cystic fibrosis. Fetal and maternal outcome". Кеуде. 118 (1): 85–91. дои:10.1378/chest.118.1.85. PMID 10893364. S2CID 32289370.
- ^ Guimbellot J, Sharma J, Rowe SM (November 2017). "Toward inclusive therapy with CFTR modulators: Progress and challenges". Pediatric Pulmonology. 52 (S48): S4–S14. дои:10.1002/ppul.23773. PMC 6208153. PMID 28881097.
- ^ Sharma J, Keeling KM, Rowe SM (August 2020). "Pharmacological approaches for targeting cystic fibrosis nonsense mutations". Еуропалық дәрілік химия журналы. 200: 112436. дои:10.1016/j.ejmech.2020.112436. PMC 7384597. PMID 32512483.
- ^ Bobadilla JL, Macek M, Fine JP, Farrell PM (June 2002). "Cystic fibrosis: a worldwide analysis of CFTR mutations--correlation with incidence data and application to screening". Адам мутациясы. 19 (6): 575–606. дои:10.1002/humu.10041. PMID 12007216.
- ^ а б c Elborn JS (November 2016). "Cystic fibrosis". Лансет. 388 (10059): 2519–2531. дои:10.1016/S0140-6736(16)00576-6. PMID 27140670. S2CID 20948144.
- ^ Short DB, Trotter KW, Reczek D, Kreda SM, Bretscher A, Boucher RC, et al. (Шілде 1998). "An apical PDZ protein anchors the cystic fibrosis transmembrane conductance regulator to the cytoskeleton". Биологиялық химия журналы. 273 (31): 19797–801. дои:10.1074/jbc.273.31.19797. PMID 9677412.
- ^ Travaglini KJ, Krasnow MA (August 2018). "Profile of an unknown airway cell". Табиғат. 560 (7718): 313–314. Бибкод:2018Natur.560..313T. дои:10.1038/d41586-018-05813-7. PMID 30097657.
- ^ а б Edwards QT, Seibert D, Macri C, Covington C, Tilghman J (November 2004). "Assessing ethnicity in preconception counseling: genetics--what nurse practitioners need to know". Американдық медбикелер практикасының академиясы журналы. 16 (11): 472–80. дои:10.1111/j.1745-7599.2004.tb00426.x. PMID 15617360. S2CID 7644129.
- ^ Childers M, Eckel G, Himmel A, Caldwell J (2007). "A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates". Медициналық гипотезалар. 68 (1): 101–12. дои:10.1016/j.mehy.2006.06.020. PMID 16934416.
- ^ Xu Y, Szép S, Lu Z (December 2009). "The antioxidant role of thiocyanate in the pathogenesis of cystic fibrosis and other inflammation-related diseases". Америка Құрама Штаттарының Ұлттық Ғылым Академиясының еңбектері. 106 (48): 20515–9. Бибкод:2009PNAS..10620515X. дои:10.1073/pnas.0911412106. PMC 2777967. PMID 19918082.
- ^ Moskwa P, Lorentzen D, Excoffon KJ, Zabner J, McCray PB, Nauseef WM, et al. (January 2007). "A novel host defense system of airways is defective in cystic fibrosis". Американдық тыныс алу және сыни медициналық көмек журналы. 175 (2): 174–83. дои:10.1164/rccm.200607-1029OC. PMC 2720149. PMID 17082494.
- ^ Conner GE, Wijkstrom-Frei C, Randell SH, Fernandez VE, Salathe M (January 2007). "The lactoperoxidase system links anion transport to host defense in cystic fibrosis". FEBS хаттары. 581 (2): 271–8. дои:10.1016/j.febslet.2006.12.025. PMC 1851694. PMID 17204267.
- ^ Verkman AS, Song Y, Thiagarajah JR (January 2003). "Role of airway surface liquid and submucosal glands in cystic fibrosis lung disease". Американдық физиология журналы. Жасуша физиологиясы. 284 (1): C2-15. дои:10.1152/ajpcell.00417.2002. PMID 12475759. S2CID 11790119.
- ^ Marieb EN, Hoehn K, Hutchinson M (2014). "22: The Respiratory System". Human Anatomy and Physiology. Pearson білімі. б. 906. ISBN 978-0805361179.
- ^ а б Saiman L (2004). "Microbiology of early CF lung disease". Педиатриялық тыныс алу туралы шолулар. 5 Suppl A (Suppl A): S367-9. дои:10.1016/S1526-0542(04)90065-6. PMID 14980298.
- ^ а б Khanolkar RA, Clark ST, Wang PW, et al. (2020). "Ecological Succession of Polymicrobial Communities in the Cystic Fibrosis Airways". mSystems. 5 (6): e00809-20. дои:10.1128/mSystems.00809-20. PMID 33262240.
- ^ а б Lorè NI, Cigana C, Riva C, De Fino I, Nonis A, Spagnuolo L, et al. (Мамыр 2016). "IL-17A impairs host tolerance during airway chronic infection by Pseudomonas aeruginosa". Ғылыми баяндамалар. 6: 25937. Бибкод:2016NatSR...625937L. дои:10.1038/srep25937. PMC 4870500. PMID 27189736.
- ^ Tümmler B, Koopmann U, Grothues D, Weissbrodt H, Steinkamp G, von der Hardt H (June 1991). "Nosocomial acquisition of Pseudomonas aeruginosa by cystic fibrosis patients". Клиникалық микробиология журналы. 29 (6): 1265–7. Бибкод:1991JPoSA..29.1265A. дои:10.1002/pola.1991.080290905. PMC 271975. PMID 1907611.
- ^ Centers for Disease Control Prevention (CDC) (Маусым 1993). "Pseudomonas cepacia at summer camps for persons with cystic fibrosis". MMWR. Сырқаттану және өлім-жітім туралы апталық есеп. 42 (23): 456–9. PMID 7684813.
- ^ Pegues DA, Carson LA, Tablan OC, FitzSimmons SC, Roman SB, Miller JM, Jarvis WR (May 1994). "Acquisition of Pseudomonas cepacia at summer camps for patients with cystic fibrosis. Summer Camp Study Group". Педиатрия журналы. 124 (5 Pt 1): 694–702. дои:10.1016/S0022-3476(05)81357-5. PMID 7513755.
- ^ Pankhurst CL, Philpott-Howard J (April 1996). "The environmental risk factors associated with medical and dental equipment in the transmission of Burkholderia (Pseudomonas) cepacia in cystic fibrosis patients". The Journal of Hospital Infection. 32 (4): 249–55. дои:10.1016/S0195-6701(96)90035-3. PMID 8744509.
- ^ Jones AM, Govan JR, Doherty CJ, Dodd ME, Isalska BJ, Stanbridge TN, Webb AK (June 2003). "Identification of airborne dissemination of epidemic multiresistant strains of Pseudomonas aeruginosa at a CF centre during a cross infection outbreak". Торакс. 58 (6): 525–7. дои:10.1136/thorax.58.6.525. PMC 1746694. PMID 12775867.
- ^ Høiby N (June 1995). "Isolation and treatment of cystic fibrosis patients with lung infections caused by Pseudomonas (Burkholderia) cepacia and multiresistant Pseudomonas aeruginosa". The Netherlands Journal of Medicine. 46 (6): 280–7. дои:10.1016/0300-2977(95)00020-N. PMID 7643943.
- ^ а б Pihet M, Carrere J, Cimon B, Chabasse D, Delhaes L, Symoens F, Bouchara JP (June 2009). "Occurrence and relevance of filamentous fungi in respiratory secretions of patients with cystic fibrosis--a review". Медициналық микология. 47 (4): 387–97. дои:10.1080/13693780802609604. PMID 19107638.
- ^ Rapaka RR, Kolls JK (2009). "Pathogenesis of allergic bronchopulmonary aspergillosis in cystic fibrosis: current understanding and future directions". Медициналық микология. 47 Suppl 1 (Suppl 1): S331-7. дои:10.1080/13693780802266777. PMID 18668399.
- ^ Mishra A, Greaves R, Massie J (November 2005). "The relevance of sweat testing for the diagnosis of cystic fibrosis in the genomic era". The Clinical Biochemist. Пікірлер. 26 (4): 135–53. PMC 1320177. PMID 16648884.
- ^ а б Davies JC, Alton EW, Bush A (December 2007). "Cystic fibrosis". BMJ. 335 (7632): 1255–9. дои:10.1136/bmj.39391.713229.AD. PMC 2137053. PMID 18079549.
- ^ Ross LF (September 2008). "Newborn screening for cystic fibrosis: a lesson in public health disparities". Педиатрия журналы. 153 (3): 308–13. дои:10.1016/j.jpeds.2008.04.061. PMC 2569148. PMID 18718257.
- ^ Assael BM, Castellani C, Ocampo MB, Iansa P, Callegaro A, Valsecchi MG (September 2002). "Epidemiology and survival analysis of cystic fibrosis in an area of intense neonatal screening over 30 years". Америкалық эпидемиология журналы. 156 (5): 397–401. дои:10.1093/aje/kwf064. PMID 12196308.
- ^ Minarowski Ł, Sands D, Minarowska A, Karwowska A, Sulewska A, Gacko M, Chyczewska E (2008). "Thiocyanate concentration in saliva of cystic fibrosis patients". Folia Histochemica et Cytobiologica. 46 (2): 245–6. дои:10.2478 / v10042-008-0037-0. PMID 18519245.
- ^ Штерн РК (1997 ж. Ақпан). «Муковисцидоз диагнозы». Жаңа Англия медицинасы журналы. 336 (7): 487–91. дои:10.1056 / NEJM199702133360707. PMID 9017943.
- ^ Фрейденхайм М (22 желтоқсан 2009). «Фиброзбен күресу құралы: тізілім». The New York Times. D1 бет. Мұрағатталды түпнұсқадан 2013 жылғы 24 мамырда. Алынған 21 желтоқсан 2009.
- ^ «Геномдық медицина дәуіріндегі тасымалдаушы скринингі». Американдық акушер-гинекологтар колледжі. 2017. Мұрағатталды түпнұсқадан 2017 жылғы 25 ақпанда. Алынған 22 ақпан 2020.
- ^ Элиас С, Аннас Г.Дж., Симпсон Дж.Л. (сәуір 1991). «Мистозды фиброзға арналған тасымалдаушы скринингі: акушерлік-гинекологиялық практиканың салдары». Американдық акушерлік және гинекология журналы. 164 (4): 1077–83. дои:10.1016 / 0002-9378 (91) 90589-j. PMID 2014829.
- ^ Табор А, Филипп Дж, Мадсен М, Банг Дж, Обель Е.Б., Норгард-Педерсен Б (маусым 1986). «Төмен қауіпті 4606 әйелдегі генетикалық амниоцентездің рандомизацияланған бақыланатын сынағы». Лансет. 1 (8493): 1287–93. дои:10.1016 / S0140-6736 (86) 91218-3. PMID 2423826. S2CID 31237495.
- ^ Эддлеман К.А., Мэлоун Ф.Д., Салливан Л, Герцог К, Берковиц РЛ, Харбутли Ю, және т.б. (Қараша 2006). «Орта мерзімді амниоцентезден кейінгі жүктіліктің жоғалуы». Акушерлік және гинекология. 108 (5): 1067–72. дои:10.1097 / 01.AOG.0000240135.13594.07. PMID 17077226. S2CID 19081825.
- ^ Дэвис Л.Б., чемпион SJ, Fair SO, Baker VL, Garber AM (сәуір 2010). «Муковисцидозды тасымалдаушы жұптар үшін имплантацияның генетикалық диагностикасының шығындар мен пайдаға талдау». Ұрықтану және стерильділік. 93 (6): 1793–804. дои:10.1016 / j.fertnstert.2008.12.053. PMID 19439290.
- ^ Хейз Д, Уилсон К.С., Кривчения К, Хокинс С.М., Балфур-Линн И.М., Гозал Д және т.б. (Ақпан 2019). «Балаларға арналған оттегі терапиясы. Американдық кеуде торы қоғамының ресми клиникалық тәжірибесі жөніндегі нұсқаулық». Американдық тыныс алу және сыни медициналық көмек журналы. 199 (3): e5-e23. дои:10.1164 / rccm.201812-2276ST. PMC 6802853. PMID 30707039.
- ^ Coffey MJ, Garg M, Homaira N, Jaffe A, Ooi CY (қаңтар 2020). «Муковисцидозы бар адамдарға арналған пробиотиктер». Cochrane жүйелік шолулардың мәліметтер базасы. 1: CD012949. дои:10.1002 / 14651858.CD012949.pub2. PMC 6984633. PMID 31962375.
- ^ Пай VB, Nahata MC (қазан 2001). «Мистозды фиброздағы аэрозолизацияланған тобрамициннің тиімділігі мен қауіпсіздігі». Педиатриялық пульмонология. 32 (4): 314–27. дои:10.1002 / ppul.1125. PMID 11568993.
- ^ Westerman EM, Le Brun PP, Touw DJ, Frijlink HW, Heijerman HG (наурыз 2004). «Мистозды фиброзбен ауыратын науқастарда небулизденген колистин сульфаты мен колистин сульфомататының өкпенің жұмысына әсері: тәжірибелік зерттеу». Мистикалық фиброз журналы. 3 (1): 23–8. дои:10.1016 / j.jcf.2003.12.005. PMID 15463883.
- ^ McCoy KS, Quittner AL, Oermann CM, Gibson RL, Retsch-Bogart GZ, Montgomery AB (қараша 2008). «Мистикалық фиброз кезінде созылмалы тыныс алу жолдары Pseudomonas aeruginosa үшін интральды азтреонам лизині». Американдық тыныс алу және сыни медициналық көмек журналы. 178 (9): 921–8. дои:10.1164 / rccm.200712-1804OC. PMC 2577727. PMID 18658109.
- ^ Райан Г, Сингх М, Дван К (наурыз 2011). «Муковисцидоз кезінде ұзақ мерзімді терапия үшін ингаляциялық антибиотиктер». Cochrane жүйелік шолулардың мәліметтер базасы (3): CD001021. дои:10.1002 / 14651858.CD001021.pub2. PMID 21412868.
- ^ «Quinsair (левофлоксацин)». Еуропалық дәрі-дәрмек агенттігі. Мұрағатталды түпнұсқадан 2016 жылғы 26 желтоқсанда. Алынған 26 желтоқсан 2016.
- ^ Langton Hewer SC, Smyth AR (сәуір 2017). «Мистозды фиброзбен ауыратын адамдардағы Pseudomonas aeruginosa-ны жоюдың антибиотикалық стратегиясы» (PDF). Cochrane жүйелік шолулардың мәліметтер базасы. 4 (4): CD004197. дои:10.1002 / 14651858.CD004197.pub5. PMC 6478104. PMID 28440853.
- ^ Смит С, Ратджен Ф, Реммингтон Т, Уотерс V (мамыр 2020). «Мистозды фиброз кезіндегі Pseudomonas aeruginosa созылмалы инфекциясы кезіндегі жедел өршу кезіндегі микробқа қарсы сезімталдықтың аралас сынағы». Cochrane жүйелік шолулардың мәліметтер базасы. 5: CD006961. дои:10.1002 / 14651858.CD006961.pub5. PMC 7387858. PMID 32412092.
- ^ Хансен CR, Pressler T, Koch C, Høiby N (наурыз 2005). «Созылмалы Pseudomonas aeruginosa инфекциясы бар муковисцидозбен ауыратын науқастарды азитромицинмен ұзақ емдеу; бақылаушы когортты зерттеу». Мистикалық фиброз журналы. 4 (1): 35–40. дои:10.1016 / j.jcf.2004.09.001. PMID 15752679.
- ^ Тан ХХ, Мулхеран М, Нокс АЖ, Смит АР (наурыз 2003). «Аминогликозидті тағайындау және муковисцидоздағы бақылау». Американдық тыныс алу және сыни медициналық көмек журналы. 167 (6): 819–23. дои:10.1164 / rccm.200109-012CC. PMID 12623858.
- ^ Hurley MN, Smith S, Forrester DL, Smyth AR (шілде 2020). «Муковисцидоз кезіндегі өкпе инфекциясының антибиотикалық адъювантты терапиясы». Cochrane жүйелік шолулардың мәліметтер базасы. 7: CD008037. дои:10.1002 / 14651858.CD008037.pub4. PMID 32671834.
- ^ Лорд Р, Джонс А.М., Хорсли А (сәуір, 2020). «Бурхолдерия цепация кешенін антибиотикпен емдеу, муковисцидозбен ауыратындарда, өкпенің өршуін бастайды». Cochrane жүйелік шолулардың мәліметтер базасы. 4: CD009529. дои:10.1002 / 14651858.CD009529.pub4. PMC 7117566. PMID 32239690.
- ^ Waters V, Ratjen F (маусым 2020). «Муковисцидозбен ауыратын адамдарда өкпенің инфекциялық емес микобактерияларын инфекцияға қарсы антибиотикалық емдеу». Cochrane жүйелік шолулардың мәліметтер базасы. 6: CD010004. дои:10.1002 / 14651858.CD010004.pub5. PMC 7389742. PMID 32521055.
- ^ Кувер Р, Ли СП (сәуір 2006). «Цистозды фиброзға арналған гипертониялық тұзды ерітінді». Жаңа Англия медицинасы журналы. 354 (17): 1848–51, автордың жауабы 1848–51. дои:10.1056 / NEJMc060351. PMID 16642591.
- ^ Либерман Дж (шілде 1968). «Мықын фиброзы кезіндегі қақырық тұтқырлығына дорназа аэрозолының әсері». Джама. 205 (5): 312–3. дои:10.1001 / jama.205.5.312. PMID 5694947.
- ^ Янг С, Монтгомери М (қыркүйек 2018). «Цистозды фиброзға арналған дорназа альфа». Cochrane жүйелік шолулардың мәліметтер базасы. 9: CD001127. дои:10.1002 / 14651858.CD001127.pub4. PMC 6513278. PMID 30187450.
- ^ Келлерман Д, Росси Моспан А, Энгельс Дж, Шаберг А, Горден Дж, Смайлик Л (тамыз 2008). «Denufosol: ингаляциялық P2Y (2) агонистерімен жүргізілген зерттеулерге шолу, бұл 3 фазаға әкелді». Өкпе фармакологиясы және терапия. 21 (4): 600–7. дои:10.1016 / j.pupt.2007.12.003. PMID 18276176.
- ^ а б Балфур-Линн И.М., Уэлч К, Смит С (шілде 2019). «Муковисцидозға арналған ингаляциялық кортикостероидтар». Cochrane жүйелік шолулардың мәліметтер базасы. 7: CD001915. дои:10.1002 / 14651858.CD001915.pub6. PMC 6609325. PMID 31271656.
- ^ Бургесс Л, Оңтүстік КВ (тамыз 2014). Бургесс Л (ред.) «Муковисцидозға арналған пневмококктық вакциналар». Cochrane жүйелік шолулардың мәліметтер базасы. 8 (8): CD008865. дои:10.1002 / 14651858.CD008865.pub3. PMID 25093421.
- ^ Dharmaraj P, Smyth RL (наурыз 2014). «Муковисцидозбен ауыратын адамдарда тұмаудың алдын алу үшін вакциналар». Cochrane жүйелік шолулардың мәліметтер базасы (3): CD001753. дои:10.1002 / 14651858.CD001753.pub3. PMC 7066935. PMID 24604671.
- ^ а б c Whiting P, Al M, Burgers L, Westwood M, Ryder S, Hoogendoorn M және т.б. (Наурыз 2014). «Муковисцидоз және G551D мутациясы бар науқастарды емдеуге арналған айвафтор: жүйелік шолу және экономикалық тиімділікті талдау». Денсаулық сақтау технологияларын бағалау. 18 (18): 1–106. дои:10.3310 / hta18180. PMC 4780965. PMID 24656117.
- ^ Wainwright CE (қазан 2014). «Цистозды фиброзбен ауыратын науқастарға арналған ивакафтор». Респираторлық медицинаның сараптамалық шолуы. 8 (5): 533–8. дои:10.1586/17476348.2014.951333. PMID 25148205. S2CID 39537446.
- ^ Комиссардың кеңсесі. «Баспасөз хабарламалары - FDA муковисцидоздың жаңа емін мақұлдады». www.fda.gov. Мұрағатталды түпнұсқасынан 2017-01-18. Алынған 2017-01-16.
- ^ «FDA кистозды фиброзды емдеуге арналған тағы бір Vertex препаратын мақұлдады - The Boston Globe».
- ^ «Tezacaftor (VX-661) кистозды фиброзға арналған - бүгін цистикалық фиброзға арналған жаңалықтар». Архивтелген түпнұсқа 2018-09-29. Алынған 2018-12-23.
- ^ а б «Trikafta (elexacaftor, ivacaftor және tezacaftor) FDA мақұлдау тарихы». Drugs.com.
- ^ Комиссар кеңсесі (2020-03-24). «FDA муковисцидозға арналған жаңа серпінді терапияны мақұлдады». FDA. Алынған 2020-08-12.
- ^ а б «Цистикалық фиброз қорының FDA-ны мақұлдауы туралы, Trikafta ™, ең көп таралған CF мутациясының алғашқы үштік терапиясы». www.cff.org. Бетезда, Мед.: Цистикалық фиброз қоры. Алынған 2020-08-12.
- ^ а б Middleton PG, Mall MA, Dřevínek P, Lands LC, McKone EF, Polineni D және т.б. (Қараша 2019). «Біртұтас Phe508del аллелі бар кистикалық фиброзға арналған Elexacaftor-Tezacaftor-Ivacaftor». Жаңа Англия медицинасы журналы. 381 (19): 1809–1819. дои:10.1056 / NEJMoa1908639. PMC 7282384. PMID 31697873.
- ^ Ридли К, Кондрен М (2020-04-01). «Elexacaftor-Tezacaftor-Ivacaftor: алғашқы үштік комбинацияланған цистикалық фиброздың трансмембраналық өткізгіштігін модуляциялаушы терапия». Педиатриялық фармакология және терапевтика журналы. 25 (3): 192–197. дои:10.5863/1551-6776-25.3.192. PMC 7134581. PMID 32265602.
- ^ «Vertex жылына 311 000 доллардан тұратын цистозды фиброзды біріктіріп емдейді». Reuters. 21 қазан 2019. Алынған 23 қазан 2019.
- ^ Жақсы жаңалықтар желісі (2019-11-03). «FDA онжылдықтардағы алғашқы жаңа кистозды фиброзды емдеуді мақұлдады». Жақсы жаңалықтар желісі. Алынған 2020-08-12.
- ^ Cheng K, Ashby D, Smyth RL (қыркүйек 2017). «Цистозды фиброзға байланысты бауыр ауруы кезіндегі урсодезоксихол қышқылы». Cochrane жүйелік шолулардың мәліметтер базасы. 9: CD000222. дои:10.1002 / 14651858.CD000222.pub4. PMC 6483662. PMID 28891588.
- ^ де Фриз Дж., Чанг А.Б., Бонифант CM, Шевилл Е, Марчант Дж.М. (тамыз 2018). «А дәрумені және бета (β) -каротинді кистозды фиброзға арналған қоспалар». Cochrane жүйелік шолулардың мәліметтер базасы. 8: CD006751. дои:10.1002 / 14651858.CD006751.pub5. PMC 6513379. PMID 30091146.
- ^ Фергюсон Дж., Чанг AB (мамыр 2014). «Цистозды фиброзға арналған Д дәрумені қоспасы». Cochrane жүйелік шолулардың мәліметтер базасы (5): CD007298. дои:10.1002 / 14651858.CD007298.pub4. PMID 24823922.
- ^ Okebukola PO, Kansra S, Barrett J (қыркүйек 2020). «Мистозды фиброзбен ауыратын адамдарда Е дәрумені қоспасы». Cochrane жүйелік шолулардың мәліметтер базасы. 9: CD009422. дои:10.1002 / 14651858.CD009422.pub4. PMID 32892350.
- ^ Джаганнат В.А., Такер V, Чанг АБ, бағасы AI (маусым 2020). «Муковисцидозға арналған К дәрумені қоспасы». Cochrane жүйелік шолулардың мәліметтер базасы. Джон Вили және ұлдары, Ltd. 6 (6): CD008482. дои:10.1002 / 14651858.CD008482.pub6. PMC 7272115. PMID 32497260.
- ^ Уотсон Н, Stackhouse C (сәуір 2020). «Муковисцидозға арналған Омега-3 май қышқылының қоспасы». Cochrane жүйелік шолулардың мәліметтер базасы. 4: CD002201. дои:10.1002 / 14651858.CD002201.pub6. PMC 7147930. PMID 32275788.
- ^ McIlwaine M, Button B, Nevitt SJ (қараша 2019). «Муковисцидозбен ауыратын адамдарда тыныс алу жолдарын тазарту үшін оң экспираторлық қысым физиотерапиясы». Cochrane жүйелік шолулардың мәліметтер базасы. 2019 (11). дои:10.1002 / 14651858.CD003147.pub5. PMC 6953327. PMID 31774149.
- ^ Андерсен Дж.Б., Квист Дж, Канн Т (қазан 1979). «Эппираторлық оң қысыммен коллаптерлық каналдар арқылы құлаған өкпені жинау». Скандинавиядағы тыныс алу аурулары журналы. 60 (5): 260–6. PMID 392747.
- ^ Groth S, Stafanger G, Dirksen H, Andersen JB, Falk M, Kelstrup M (шілде 1985). «Экспираторлық оң қысым (PEP-маска) физиотерапиясы желдетуді жақсартады және муковисцидоздағы ұсталған газ көлемін азайтады». Européen de Physiopathologie Respiratoire бюллетені. 21 (4): 339–43. PMID 3899222.
- ^ а б c Moran F, Bradley JM, Piper AJ (ақпан 2017). «Мистозды фиброзға арналған инвазивті емес желдету». Cochrane жүйелік шолулардың мәліметтер базасы. 2: CD002769. дои:10.1002 / 14651858.CD002769.pub5. PMC 6464053. PMID 28218802.
- ^ Moran F, Bradley JM, Piper AJ (ақпан 2017). «Мистозды фиброзға арналған инвазивті емес желдету». Cochrane жүйелік шолулардың мәліметтер базасы. 2 (2): CD002769. дои:10.1002 / 14651858.CD002769.pub5. PMC 6464053. PMID 28218802.
- ^ «Трахеостомия Неліктен қолданылады». NHS. Алынған 10 мамыр 2020.
- ^ Хут ММ, Зинк К.А., Ван Хорн НР (2005). «Мистатикалық терапияның цистозды фиброзы бар жастардың нәтижелерін жақсартудағы әсері: дәлелдерге шолу». Педиатриялық мейірбике. 31 (4): 328–32. PMID 16229132.
- ^ Leinwand MJ (28 желтоқсан 2019). Windle ML, Odim J (ред.). «Өкпе, плевра және медиастин инфекцияларын хирургиялық емдеу». Көрініс. Архивтелген түпнұсқа 2016-10-05.
- ^ Fridell JA, Vianna R, Kwo PY, Howenstine M, Sannuti A, Molleston JP және т.б. (Қазан 2005). «Цистозды фиброзбен ауыратын науқастарда бауыр мен ұйқы безін бір уақытта трансплантациялау». Трансплантациялау туралы материалдар. 37 (8): 3567–9. дои:10.1016 / j.transproceed.2005.09.091. PMID 16298663.
- ^ Belkin RA, Henig NR, Singer LG, Chaparro C, Rubenstein RC, Xie SX және т.б. (Наурыз 2006). «Өкпенің трансплантациясын күткен муковисцидозбен ауыратын науқастардың өлім қаупінің факторлары». Американдық тыныс алу және сыни медициналық көмек журналы. 173 (6): 659–66. дои:10.1164 / rccm.200410-1369OC. PMC 2662949. PMID 16387803.
- ^ а б «Цистозды фиброз - педиатрия». Merck Manuals Professional Edition. Алынған 2020-08-12.
- ^ Сомараджу UR, Солис-Моя А (тамыз 2020). «Муковисцидозы бар адамдарға арналған ұйқы безі ферменттерін алмастыру терапиясы». Cochrane жүйелік шолулардың мәліметтер базасы. 8: CD008227. дои:10.1002 / 14651858.CD008227.pub4. PMID 32761612.
- ^ Zirbes J, Милла CE (қыркүйек 2009). «Мистикалық фиброзға байланысты қант диабеті». Педиатриялық тыныс алу туралы шолулар. 10 (3): 118–23, викторина 123. дои:10.1016 / j.prrv.2009.04.004. PMID 19651382.
- ^ Onady GM, Stolfi A (сәуір 2016). «Муковисцидозға байланысты диабетті басқаруға арналған инсулин және пероральді агенттер». Cochrane жүйелік шолулардың мәліметтер базасы. 4: CD004730. дои:10.1002 / 14651858.CD004730.pub4. PMID 27087121.
- ^ Onady GM, Stolfi A (қазан 2020). «Цистозды фиброзбен байланысты қант диабетін емдеу үшін дәрі-дәрмектермен емдеу». Cochrane жүйелік шолулардың мәліметтер базасы. 10: CD004730. дои:10.1002 / 14651858.CD004730.pub5. PMID 33075159.
- ^ Amin R, Jahnke N, Waters V (наурыз 2020). «Мистозды фиброзбен ауыратын адамдардағы мальтофилия стенотрофоманы антибиотикпен емдеу». Cochrane жүйелік шолулардың мәліметтер базасы. 3: CD009249. дои:10.1002 / 14651858.CD009249.pub5. PMC 7080526. PMID 32189337.
- ^ а б c Conwell LS, Chang AB (наурыз 2014). «Мистозды фиброзбен ауыратын адамдардағы остеопорозға арналған бисфосфонаттар». Cochrane жүйелік шолулардың мәліметтер базасы (3): CD002010. дои:10.1002 / 14651858.CD002010.pub4. PMC 6718208. PMID 24627308.
- ^ Hardin DS, Rice J, Ahn C, Ferkol T, Howenstine M, Spears S және т.б. (Наурыз 2005). «Өсу гормонын емдеу энтеральды тамақтануды алатын муковисцидозбен ауыратын балалардың тамақтануын және өсуін күшейтеді». Педиатрия журналы. 146 (3): 324–8. дои:10.1016 / j.jpeds.2004.10.037. PMID 15756212.
- ^ Маркс SC, Kissner DG (1997). «Ересек цистозды фиброздағы синуситті басқару». Американдық ринология журналы. 11 (1): 11–4. дои:10.2500/105065897781446810. PMID 9065342. S2CID 5606258.
- ^ Phillipson GT, Petrucco OM, Matthews CD (ақпан 2000). «Vas deferens-тің туа біткен екіжақты болмауы, муковисцидозды мутация анализі және интрацитоплазмалық ұрық инъекциясы». Адамның көбеюі. 15 (2): 431–5. дои:10.1093 / humrep / 15.2.431. PMID 10655317.
- ^ Ciofu O, Lykkesfeldt J (тамыз 2014). «Муковисцидоз кезіндегі өкпе ауруы кезіндегі антиоксидантты қоспалар». Cochrane жүйелік шолулардың мәліметтер базасы. 8 (8): CD007020. дои:10.1002 / 14651858.CD007020.pub3. PMID 25102015.
- ^ а б Радтке Т, Невитт СЖ, Хебестрейт Х, Криемлер С (қараша 2017). «Мистозды фиброзға арналған дене шынықтыру жаттығулары». Cochrane жүйелік шолулардың мәліметтер базасы. 11: CD002768. дои:10.1002 / 14651858.CD002768.pub4. PMC 6485991. PMID 29090734.
- ^ Ganesan P, Schmiedge J, Manchaiah V, Swapna S, Dhandayutham S, Kothandaraman PP (сәуір 2018). «Ототоксичность: диагностика мен емдеудегі қиындық». Аудиология және отология журналы. 22 (2): 59–68. дои:10.7874 / jao.2017.00360. PMC 5894487. PMID 29471610.
- ^ Дэвис П.Б (наурыз 2006). «1938 жылдан бастап кистозды фиброз». Американдық тыныс алу және сыни медициналық көмек журналы. 173 (5): 475–82. дои:10.1164 / rccm.200505-840OE. PMID 16126935. S2CID 1770759.
- ^ МакКензи Т, Гиффорд А.Х., Сабадоса К.А., Куинтон Х.Б., Кнапп Э.А., Госс Ч, Маршалл BC (тамыз 2014). «2000-2010 жж. Және одан кейінгі жылдарда муковисцидозбен ауыратын науқастардың ұзақ өмір сүруі: цистикалық фиброз қорының пациенттер тізілімінің өмір сүруін талдау». Ішкі аурулар шежіресі. 161 (4): 233–41. дои:10.7326 / m13-0636. PMC 4687404. PMID 25133359.
- ^ «Канадалық фиброздың пациенттер туралы деректерін тіркеу туралы есеп» (PDF). Канадалық цистикалық фиброз қоры. 2007. мұрағатталған түпнұсқа (PDF) 2010-07-15. Алынған 2010-03-14.
- ^ «Жылдық деректер туралы есеп-2016 фиброзды кистикалық қормен пациенттер тізілімі» (PDF). б. 4. Алынған 19 маусым 2018.
- ^ «2009 жылы цистикалық фиброзбен ауыратын науқастардың тіркелімі туралы жылдық есеп» (PDF). Цистикалық фиброздың қоры. 2009. мұрағатталған түпнұсқа (PDF) 2012-01-05.
- ^ Ю Х, Наср С.З., Деретик V (сәуір 2000). «Мистикалық фиброз кезіндегі респираторлық инфекциялардың тамақтанбаған тышқан моделіндегі өкпенің табиғи қорғанысы және Pseudomonas aeruginosa клиренсі». Инфекция және иммунитет. 68 (4): 2142–7. дои:10.1128 / IAI.68.4.2142-2147.2000. PMC 97396. PMID 10722612.
- ^ Ratjen F, Döring G (ақпан 2003). «Мистикалық фиброз». Лансет. 361 (9358): 681–9. дои:10.1016 / S0140-6736 (03) 12567-6. PMID 12606185. S2CID 24879334.
- ^ Розенштейн Б.Ж., Цейтлин ПЛ (қаңтар 1998). «Мистикалық фиброз». Лансет. 351 (9098): 277–82. дои:10.1016 / S0140-6736 (97) 09174-5. PMID 9457113. S2CID 44627706.
- ^ Шмитц Т.Г., Голдбек Л (ақпан 2006). «Мистозды фиброзбен ауыратын науқастардың өмір сапасына стационарлық оңалту бағдарламаларының әсері: көп орталықты зерттеу». Денсаулық және өмір сапасы. 4: 8. дои:10.1186/1477-7525-4-8. PMC 1373610. PMID 16457728.
- ^ Hegarty M, Macdonald J, Watter P, Wilson C (шілде 2009). «Муковисцидозы бар жастардың өмір сапасы: ауруханаға жатқызудың әсері, жас және жыныс, ата-ана мен баланың қабылдауындағы айырмашылықтар». Бала. 35 (4): 462–8. дои:10.1111 / j.1365-2214.2008.00900.x. PMID 18991968.
Havermans T, Vreys M, Proesmans M, De Boeck C (қаңтар 2006). «Ата-аналар мен балалар арасындағы циста фиброзы бар балалардың денсаулығына байланысты өмір сапасы туралы келісімді бағалау». Бала. 32 (1): 1–7. дои:10.1111 / j.1365-2214.2006.00564.x. PMID 16398786. - ^ Moorcroft AJ, Dodd ME, Webb AK (1998). «Жатырдың фиброзы бар науқастарға арналған жаттығулардың шектеулері және жаттығулары». Мүгедектік және оңалту. 20 (6–7): 247–53. дои:10.3109/09638289809166735. PMID 9637933.
- ^ «Дәрілер». Кисталық фиброз Канада. 2011. № 10684-5100 RR0001. Архивтелген түпнұсқа 2011-09-04.
- ^ Araújo FG, Novaes FC, Santos NP, Martins VC, Souza SM, Santos SE, Ribeiro-dos-Santos AK (қаңтар 2005). «Бразилияның солтүстігінде цистозды фиброзбен ауыратын науқастар арасында deltaF508, G551D, G542X және R553X мутацияларының таралуы». Бразилиялық медициналық-биологиялық зерттеулер журналы = Revista Brasileira de Pesquisas Medicas e Biologicas. 38 (1): 11–5. дои:10.1590 / S0100-879X2005000100003. PMID 15665983.
- ^ Тобиас Е (2011). Маңызды медициналық генетика. Джон Вили және ұлдары. б. 312. ISBN 978-1-118-29370-6. Мұрағатталды түпнұсқасынан 2016-04-17.
- ^ «Мусталық фиброз туралы канадалық фактілер мен деректер». Архивтелген түпнұсқа 2013-06-16.
- ^ «Генетикалық тасымалдаушының сынағы». Цистикалық фиброздың қоры. 2007. мұрағатталған түпнұсқа 2010-03-23.
- ^ Розенштейн Б.Ж., Cutting GR (сәуір 1998). «Муковисцидоз диагнозы: консенсус мәлімдемесі. Муковисцидоз негізінің келісім кеңесі». Педиатрия журналы. 132 (4): 589–95. дои:10.1016 / S0022-3476 (98) 70344-0. PMID 9580754.
- ^ Hamosh A, FitzSimmons SC, Macek M, Knowles MR, Rosenstein BJ, Cutting GR (ақпан 1998). «Қара және ақ пациенттердегі муковисцидоздың клиникалық көріністерін салыстыру». Педиатрия журналы. 132 (2): 255–9. дои:10.1016 / S0022-3476 (98) 70441-X. PMID 9506637.
- ^ Фаррелл П, Джофф С, Фоли Л, Кэнни Г.Дж., Мейн П, Розенберг М (қыркүйек 2007). «Ирландия Республикасындағы муковисцидоздың диагностикасы: эпидемиология және шығындар». Irish Medical Journal. 100 (8): 557–60. PMID 17955689. Архивтелген түпнұсқа 2013-12-03.
- ^ Hytönen M, Patjas M, Vento SI, Kauppi P, Malmberg H, Ylikoski J, Kere J (желтоқсан 2001). «Финляндиядағы созылмалы синуситпен ауыратын науқастардың мукта фиброзды гендік мутациясы deltaF508 және 394delTT». Acta Oto-Laryngologica. 121 (8): 945–7. дои:10.1080/000164801317166835. PMID 11813900.
- ^ «ДДҰ | Гендер және адам ауруы». Кім. 2010-12-07. Мұрағатталды түпнұсқасынан 2012-10-20. Алынған 2013-01-23.
- ^ Рассел П (2011). Биология: динамикалық ғылым (2-ші басылым). Белмонт, Калифорния: Брукс / Коул, Cengage Learning. б. 304. ISBN 978-0-538-49372-7. Мұрағатталды түпнұсқасынан 2016-04-17.
- ^ «Мистозды фиброзға генетикалық сынақ. Консенсусты дамыту жөніндегі конференция мәлімдемесі. Ұлттық денсаулық сақтау институттары. 14-16 сәуір 1997 ж. Мұрағатталды түпнұсқасынан 2009-03-27.
- ^ Розенфельд М, Дэвис Р, ФитцСиммонс С, Пепе М, Рэмси Б (мамыр 1997). «Цистозды фиброз өліміндегі гендерлік алшақтық». Америкалық эпидемиология журналы. 145 (9): 794–803. дои:10.1093 / oxfordjournals.aje.a009172. PMID 9143209.
- ^ Coakley RD, Sun H, Clunes LA, Rasmussen JE, Stackhouse JR, Okada SF және т.б. (Желтоқсан 2008). «17бета-эстрадиол тыныс алу жолдарының эпителияындағы цистозды фиброздағы тыныс алу жолдарының беткі сұйықтығының Са2 + тәуелді гомеостазын тежейді». Клиникалық тергеу журналы. 118 (12): 4025–35. дои:10.1172 / JCI33893. PMC 2582929. PMID 19033671.
- ^ Верма Н, Буш А, Бухдал Р (қазан 2005). «Цистозды фиброзда әлі де жыныстық алшақтық бар ма?». Кеуде. 128 (4): 2824–34. дои:10.1378 / кеуде.128.4.2824. PMID 16236961.
- ^ Моран А, Дуниц Дж, Натан Б, Саид А, Холме Б, Томас В (қыркүйек 2009). «Цистозды фиброзға байланысты диабет: таралу, аурушаңдық және өлімнің қазіргі тенденциялары». Қант диабетіне күтім. 32 (9): 1626–31. дои:10.2337 / dc09-0586. PMC 2732133. PMID 19542209.
- ^ «Эстрогеннің әсерінен әйелдерге арналған CF нашарлайды»'". The Irish Times. 8 тамыз, 2010 жыл. Мұрағатталды түпнұсқадан 11 тамыз 2010 ж.
- ^ Wennberg C, Kucinskas V (1994). «Фин-Угрия және Балтық популяцияларындағы дельта F508 мутациясының төмен жиілігі». Адам тұқым қуалаушылық. 44 (3): 169–71. дои:10.1159/000154210. PMID 8039801.
- ^ Kere J, Savilahti E, Norio R, Estivill X, de la Chapelle A (қыркүйек 1990). «Финляндиядағы мукия фиброзының мутациялық дельта F508: басқа мутациялар басым». Адам генетикасы. 85 (4): 413–5. дои:10.1007 / BF02428286. PMID 2210753. S2CID 38364780.
- ^ Wiuf C (тамыз 2001). «Delta F508 гетерозиготаларының селективті артықшылығы бар ма?». Генетикалық зерттеулер. 78 (1): 41–7. CiteSeerX 10.1.1.174.7283. дои:10.1017 / S0016672301005195. PMID 11556136.
- ^ Габриэль С.Е., Бригман К.Н., Коллер Б.Х., Баучер RC, Штуттс МДж (қазан 1994). «Тінтуірдің мукистозды фиброзы моделіндегі холера токсиніне гетерозиготаға төзімділік». Ғылым. 266 (5182): 107–9. Бибкод:1994Sci ... 266..107G. дои:10.1126 / ғылым.7524148. PMID 7524148.
- ^ Альфонсо-Санчес МА, Перес-Миранда А.М., Гарсия-Обрегон С, Пенья Дж.А. (маусым 2010). «Еуропалық популяциялардағы Delta F508 CFTR мутациясының жоғары жиілігіне эволюциялық көзқарас». Медициналық гипотезалар. 74 (6): 989–92. дои:10.1016 / j.mehy.2009.12.018. PMID 20110149.
- ^ Катберт AW, Halstead J, Ratcliff R, Colledge WH, Evans MJ (қаңтар 1995). «Цистозды фиброздың гетерозиготаларындағы генетикалық артықшылық гипотезасы: миренді зерттеу». Физиология журналы. 482 (Pt 2): 449-54. дои:10.1113 / jphysiol.1995.sp020531. PMC 1157742. PMID 7714835.
- ^ Högenauer C, Santa Ana CA, Porter JL, Millard M, Gelfand A, Rosenblatt RL, et al. (Желтоқсан 2000). «Мистикалық фиброз мутациясының адам тасымалдағыштарындағы ішек хлоридінің белсенді секрециясы: гетерозиготалардың ішек хлоридінің субормальды белсенді секрециясы бар деген гипотезаны бағалау». Американдық генетика журналы. 67 (6): 1422–7. дои:10.1086/316911. PMC 1287919. PMID 11055897.
- ^ Pier GB, Grout M, Zaidi T, Meluleni G, Mueschenborn SS, Banting G және т.б. (Мамыр 1998). «Salmonella typhi ішектің эпителий жасушаларына ену үшін CFTR қолданады». Табиғат. 393 (6680): 79–82. Бибкод:1998 ж.393 ... 79P. дои:10.1038/30006. PMID 9590693. S2CID 5894247.
- ^ Модиано Г, Чиминелли Б.М., Пигнатти ПФ (наурыз 2007). «Мистикалық фиброз және лактаза персистенциясы: мүмкін корреляция». Еуропалық адам генетикасы журналы. 15 (3): 255–9. дои:10.1038 / sj.ejhg.5201749. PMID 17180122. S2CID 4650571.
- ^ Пулман EM, Galvani AP (ақпан 2007). «Муковисцидозға арналған селективті қысымға үміткер агенттерді бағалау». Корольдік қоғам журналы, Интерфейс. 4 (12): 91–8. дои:10.1098 / rsif.2006.0154. PMC 2358959. PMID 17015291.
- ^ Уильямс Н (2006). «Туберкулездің жаңа қауіп-қатерінен із іздейді». Қазіргі биология. 16 (19): R821-R822. дои:10.1016 / j.cub.2006.09.009. S2CID 2346727.
- ^ Tobacman JK (маусым 2003). «Арилсульфатаза В жетіспеушілігі муковисцидозда маңызды ма?». Кеуде. 123 (6): 2130–9. дои:10.1378 / кеуде.123.6.2130. PMID 12796199.
- ^ а б c Busch R (1990). «Мистикалық фиброздың тарихы туралы». Acta Universitatis Carolinae. Медика. 36 (1–4): 13–5. PMID 2130674.
- ^ Фанкони Г, Уехлингер Е, Кнауер С (1936). «Das coeliakiesyndrom bei angeborener zysticher pankreasfibromatose und bronchiektasien». Wien. Мед. WSCHR. 86: 753–6.
- ^ Di Sant'Agnese PA, Darling RC, Perera GA, Shea E (1953 қараша). «Ұйқы безінің муковисцидозындағы тердің электролиттік құрамының қалыптан тыс болуы; клиникалық маңызы және аурумен байланысы». Педиатрия. 12 (5): 549–63. PMID 13111855.
- ^ Riordan JR, Rommens JM, Kerem B, Alon N, Rozmahel R, Grzelczak Z және т.б. (Қыркүйек 1989). «Цистозды фиброз генін анықтау: клондау және комплементарлы ДНҚ сипаттамасы». Ғылым. 245 (4922): 1066–73. Бибкод:1989Sci ... 245.1066R. дои:10.1126 / ғылым.2475911. PMID 2475911.
- ^ Rommens JM, Iannuzzi MC, Kerem B, Drumm ML, Melmer G, Dean M және т.б. (Қыркүйек 1989). «Цистозды фиброз генін анықтау: хромосомамен жүру және секіру». Ғылым. 245 (4922): 1059–65. Бибкод:1989Sci ... 245.1059R. дои:10.1126 / ғылым.2772657. PMID 2772657.
- ^ Ли ТВ, Оңтүстік КВ, Перри ЛА, Пенни-Димри JC, Аслам АА (маусым 2016). Оңтүстік КВ (ред.) «Жергілікті цисталық фиброздың трансмембраналық өткізгіштік реттегіші, муковисцидозға байланысты өкпе ауруы үшін генді ауыстыру». Cochrane жүйелік шолулардың мәліметтер базасы (6): CD005599. дои:10.1002 / 14651858.CD005599.pub5. PMID 27314455.
- ^ Alton EW, Armstrong DK, Ashby D, Bayfield KJ, Bilton D, Bloomfield EV және т.б. (Қыркүйек 2015). «Муковисцидозы бар науқастарда вирустық емес CFTR гендік терапиясының қайталанған небулизациясы: рандомизацияланған, екі соқыр, плацебо-бақыланатын, 2b фазалық сынақ». Лансет. Тыныс алу медицинасы. 3 (9): 684–691. дои:10.1016 / S2213-2600 (15) 00245-3. PMC 4673100. PMID 26149841.
- ^ Рамалхо А.С., Бек С, Мейер М, Пенк Д, Кесу GR, Амарал MD (қараша 2002). «Қалыпты цистикалық фиброздың трансмембраналық өткізгіштік реттегішінің бес пайызы mRNA муковисцидоздағы өкпе ауруының ауырлығын жақсартады». Американдық тыныс алу клеткасы және молекулалық биология журналы. 27 (5): 619–27. дои:10.1165 / rcmb.2001-0004oc. PMID 12397022. S2CID 8714332.
- ^ Тейт С, Элборн С (наурыз 2005). «Муковисцидоз үшін гендік терапияға бағытталған прогресс». Есірткіні жеткізу туралы сарапшылардың пікірі. 2 (2): 269–80. дои:10.1517/17425247.2.2.269. PMID 16296753. S2CID 30948229.
- ^ Адамдағы онлайн менделік мұра (OMIM): ЦИСТИКАЛЫҚ ФИБРОЗ; CF - 219700
- ^ Schwank G, Koo BK, Sasselli V, Dekkers JF, Heo I, Demircan T және т.б. (Желтоқсан 2013). «Цисталы фиброзбен ауыратын науқастардың ішек бағаналы жасуша органоидтарындағы CRISPR / Cas9 арқылы CFTR функционалды қалпына келтіру». Ұяшықтың өзегі. 13 (6): 653–8. дои:10.1016 / j.stem.2013.11.002. PMID 24315439.
- ^ Hraiech S, Brégeon F, Rolain JM (2015). «Цистозды фиброзбен байланысты Pseudomonas aeruginosa инфекцияларындағы бактериофагқа негізделген терапия: негізі және қазіргі жағдайы». Дәрілерді жобалау, дамыту және терапия. 9: 3653–63. дои:10.2147 / DDDT.S53123. PMC 4509528. PMID 26213462.
- ^ Trend S, Fonceca AM, Ditcham WG, Kicic A, Cf A (қараша 2017). «Муковисцидоздағы фаготерапияның әлеуеті: адам мен бактерия-фагтың маңызды өзара әрекеттесуі және Pseudomonas aeruginosa жұқтырған тыныс алу жолдарында қолдану туралы түсініктер». Мистикалық фиброз журналы. 16 (6): 663–670. дои:10.1016 / j.jcf.2017.06.012. PMID 28720345.
- ^ а б Ramsey BW, Downey GP, Goss CH (мамыр 2019). «Цистикалық фиброздағы жаңарту 2018». Американдық тыныс алу және сыни медициналық көмек журналы. 199 (10): 1188–1194. дои:10.1164 / rccm.201902-0310UP. PMC 6519861. PMID 30917288. ProQuest 2230820891.
- ^ Dietz HC (тамыз 2010). «Мендия бұзылыстарына жаңа терапиялық тәсілдер». Жаңа Англия медицинасы журналы. 363 (9): 852–63. дои:10.1056 / NEJMra0907180. PMID 20818846. S2CID 5809127. Тегін толық мәтін
- ^ а б Комиссар кеңсесі (2019-10-24). «FDA муковисцидозға арналған жаңа серпінді терапияны мақұлдады». FDA. Алынған 2019-11-13.
- ^ «CFTR модулятор терапиясы». Бетезда, Мед.: Цистикалық фиброз қоры. Алынған 2019-11-13.
- ^ Sherrard LJ, McGrath SJ, McIlreavey L, Hatch J, Wolfgang MC, Muhlebach MS, Gilpin DF, Elborn JS, Tunney MM (ақпан 2016). «Кеңейтілген спектрлі бета-лактамазалар өндірісі және муковисцидті микробтаның превотелла изоляттарының жанама патогендік рөлі». Int J микробқа қарсы агенттер. 47 (2): 140–145. дои:10.1016 / j.ijantimicag.2015.12.004. PMID 26774156.
Сыртқы сілтемелер
| Жіктелуі | |
|---|---|
| Сыртқы ресурстар |
- Мистикалық фиброз кезінде Керли
- cf кезінде NIH /UW Ген-тесттер
- Муковисцидозға қатысатын гендерді GeneCard-тан іздеңіз
- Цистикалық фиброздың мутациясы туралы мәліметтер базасы
- «Мистикалық фиброз». MedlinePlus. АҚШ ұлттық медицина кітапханасы.