Миозин-жеңіл тізбекті фосфатаза - Myosin-light-chain phosphatase
| Миозинді жеңіл тізбекті фосфатаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 PP1 мен MYPT1 бөлігі арасындағы кешеннің құрылымы, 1s70 бастап түзілген[1] | |||||||||
| Идентификаторлар | |||||||||
| EC нөмірі | 3.1.3.53 | ||||||||
| CAS нөмірі | 86417-96-1 | ||||||||
| Мәліметтер базасы | |||||||||
| IntEnz | IntEnz көрінісі | ||||||||
| БРЕНДА | BRENDA жазбасы | ||||||||
| ExPASy | NiceZyme көрінісі | ||||||||
| KEGG | KEGG кірісі | ||||||||
| MetaCyc | метаболизм жолы | ||||||||
| PRIAM | профиль | ||||||||
| PDB құрылымдар | RCSB PDB PDBe PDBsum | ||||||||
| Ген онтологиясы | AmiGO / QuickGO | ||||||||
| |||||||||
Миозинді жеңіл тізбекті фосфатаза, жиі деп аталады миозинфосфатаза (EC 3.1.3.53 ), болып табылады фермент (нақты а серинге / треонинге тән протеин фосфатаза ) бұл депосфорилаттар реттегіш жарық тізбегі миозин II. Бұл депосфорилдену реакциясы тегіс бұлшықет тіні және бұлшықет жасушаларының релаксация процесін бастайды. Осылайша, миозинфосфатаза кері қайтарады бұлшықеттің жиырылуы басталған процесс миозинді жеңіл тізбекті киназа. Фермент үш суббірліктен тұрады: каталитикалық аймақ (ақуыз фосфатазы 1, немесе PP1), миозинді байланыстыратын суббірлік (MYPT1) және белгісіз функцияның үшінші суббірлігі (M20). Каталитикалық аймақ екі пайдаланады марганец миозиндегі конформациялық өзгерісті тудыратын және бұлшықетті босаңсытатын миозиндегі жарық тізбектерін фосфорсыздандыратын катализатор ретіндегі иондар. Фермент жоғары деңгейде сақталған[1] және барлық организмдердің тегіс бұлшықет тінінде кездеседі. Миозинфосфатазаның реттелетіні белгілі ро-байланысқан ақуыз киназалары, сияқты басқа молекулалар туралы пікірталастар бар, мысалы арахидон қышқылы және лагері, сонымен қатар ферментті реттейді.[2]
Функция
Тегіс бұлшықет тіндері негізінен жасалған актин және миозин,[3] бұлшықеттің жиырылуын және релаксациясын жасау үшін өзара әрекеттесетін екі ақуыз. Кәдімгі миозин деп те аталатын II миозиннің бас және құйрық домендерінен тұратын екі ауыр тізбегі және «мойын» аймағындағы ауыр тізбектермен байланысатын төрт жеңіл тізбегі (басына екіден) бар. Бұлшықет жиырылуы керек болғанда, кальций иондары цитозол бастап саркоплазмалық тор, онда олар кальмодулинді белсендіреді, ол өз кезегінде белсендіріледі миозинді жеңіл тізбекті киназа (MLC киназа). MLC киназа миозинді жарық тізбегін (MLC) фосфорлайды20) Ser-19 қалдықтарында. Бұл фосфорлану миозиннің конформациялық өзгеруіне әкеліп соғады велосипедпен жүру және бұлшықеттің жиырылуын тудырады. Миозин конформациялық өзгеріске ұшырағандықтан, кальций мен активтендірілген MLC киназа концентрациясын қалыпты деңгейге жеткізген кезде де бұлшық ет жиырыла береді. Бұлшықетті босаңсу үшін конформациялық өзгерісті болдырмау керек.[4]
Миозинфосфатаза миозинмен байланысқан кезде, ол фосфат тобы. Топсыз миозин өзінің бастапқы конформациясына оралады, онда ол актинмен әрекеттесе алмайды және бұлшықет кернеулігін ұстай алмайды, сондықтан бұлшықет босаңсады. Бұлшықет босаңсыған күйінде миозин MLC киназа әсерінен фосфорланғанға дейін және конформациялық өзгеріске ұшырағанша қалады.
Құрылым

Миозинфосфатаза үш суббірліктен тұрады. Каталитикалық суббірлік, PP1, ішіндегі маңызды Ser / Thr фосфатазаларының бірі болып табылады эукариотты жасушалар, бұл рөл атқарады гликоген метаболизм, жасушаішілік тасымалдау, ақуыз синтезі және жасушалардың бөлінуі сонымен қатар тегіс бұлшықеттің жиырылуы.[5] Бұл жасушаның негізгі функциялары үшін өте маңызды болғандықтан және клеткалардағы протеин фосфатазалары киназаларға қарағанда әлдеқайда аз,[6] PP1 құрылымы мен функциясы жоғары деңгейде сақталған (бірақ миозинфосфатазада қолданылатын ерекше изоформ - δ изоформ, PP1δ).[7] PP1 марганецтің екі ионын депосфорилденудің катализаторы ретінде қолданады (төменде қараңыз).
Осы иондарды қоршап тұрған үш ойығы бар Y-тәрізді саңылау: гидрофобты, қышқылдық және С-терминалды ойық. PP1 басқа суббірлікпен байланыспаған кезде, ол ерекше емес. Бірақ ол миозинфосфатазаның екінші суббірлігімен байланысқан кезде MYPT1 (MW ~ 130 кДа), бұл каталитикалық саңылау конфигурацияны өзгертеді. Бұл миозиннің ерекшелігінің күрт өсуіне әкеледі.[1] Сонымен, MYPT1 PP1 және миозинфосфатаза бойынша, тіпті басқа активаторлар мен ингибиторларсыз да үлкен реттеуші күшке ие екендігі түсінікті.
Үшінші кіші бөлім, M20 (MLC-мен шатастыруға болмайды)20, миозиннің маңызды реттеуші суббірлігі), бұл ең кіші және жұмбақ суббірлік. Қазіргі уақытта M20 туралы көп нәрсе білмейді, тек катализ үшін қажет емес, өйткені суббірлікті алып тастау айналымға немесе селективтілікке әсер етпейді.[1] Кейбіреулер оның реттеуші функциясы болуы мүмкін деп санаса да, әлі ештеңе анықталған жоқ.[2]
Механизм
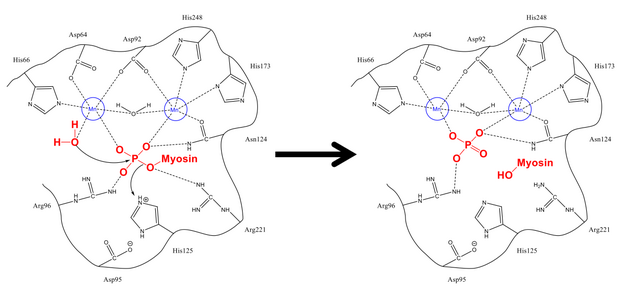
Фосфатты Ser-19-дан тазарту механизмі жасушадағы басқа фосфорлану реакцияларына өте ұқсас, мысалы, гликоген синтазы. Миозиннің MLC реттеуші суббірлігі20 PP1 және MYPT1 гидрофобты және қышқыл ойықтарымен байланысады, миозинфосфатазаның реттеуші орны.[1][8] Тиісті конфигурацияға түскеннен кейін екеуі де фосфорилденеді серин және бос су молекуласы белсенді учаскедегі сутегімен байланысқан қалдықтармен, сондай-ақ оң зарядталған иондармен тұрақталады (олар теріс фосфат тобымен өзара әрекеттеседі). Хис-125 (миозинфосфатазада) протонды Ser-19 MLC-ге бөледі20), ал су молекуласы фосфор атомы. Протондарды тұрақтандыру үшін араластырғаннан кейін (бұл фосфорға шабуылмен салыстырғанда тез жүреді), фосфат пен алкоголь түзіліп, екеуі де белсенді аймақтан шығады.
Реттеу және адам денсаулығы
MLC киназасының реттелетін жолдары әбден қалыптасқан, бірақ 1980 жылдардың соңына дейін миозинфосфатаза реттелмеген, ал жиырылу / босаңсу MLC киназа белсенділігіне толық тәуелді болды.[2] Алайда, 1980-ші жылдардан бастап, ро-байланысқан протеинкиназаның тежегіш әсері анықталды және мұқият зерттелді.[11] RhoA GTP қосылады Ро-киназа, бұл MYPT1-ді екі негізгі ингибиторлық орындарда, Thr-696 және Thr-866 фосфорлайды.[12][13] Бұл реакция жылдамдығы мен ерекшелігін арттыру үшін ғана емес, сонымен қатар реакцияны едәуір баяулататын MYPT1 мәнін толық көрсетеді. Алайда, қашан телокин қосылады, ол MYPT1-ді фосфорландырмаса да, Rho-kinase әсерін тиімді түрде жояды.[12]
Арахидон қышқылын ұсынатын тағы бір реттеуші стратегия. Арахидон қышқылын кернелген бұлшықет тініне қосқанда, қышқыл миозиннің депосфорлану жылдамдығын төмендетеді (демек, релаксация). Алайда, арахидон қышқылының қалай жұмыс істейтіні түсініксіз ингибитор.[4] Екі бәсекелес теория - арахидон қышқылы жоғарыда аталған ро-киназа каскадында қосалқы хабаршы қызметін атқарады немесе ол MYPT1 с-терминалымен байланысады.[4]
Миозинфосфатазаның реттеуші жүйелері істен шыға бастаған кезде денсаулыққа үлкен салдары болуы мүмкін. Тегіс бұлшықет адамның тыныс алу, қанайналым және репродуктивті жүйелерінде (сонымен қатар басқа жерлерде) кездесетіндіктен, егер тегіс бұлшықет дұрыс реттелмегендіктен енді босаңсый алмаса, онда көптеген проблемалардан бастап астма, гипертония, және эректильді дисфункция нәтиже беруі мүмкін.[4][14]
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ а б c г. e Террак, Мұхаммед; Керф, Фредерик; т.б. (2004 жылғы 17 маусым). «Ақуызды фосфатазаны реттеудің құрылымдық негіздері». Табиғат. 429 (6993): 780–4. Бибкод:2004 ж. Табиғат.429..780Т. дои:10.1038 / табиғат02582. PMID 15164081.
- ^ а б c Хартшорн, ди-джей; Ito, M (мамыр 1998). «Миозинді жеңіл тізбекті фосфатаза: суббірлік құрамы, өзара әрекеттесуі және реттелуі». J Muscle Res Cell Motil. 19 (4): 325–41. дои:10.1023 / A: 1005385302064. PMID 9635276. S2CID 27448238.
- ^ 174 бет ішінде: Тамырлы тегіс бұлшықет жасушасы: жасушадан тыс матрицаға молекулалық және биологиялық реакциялар. Авторлары: Стивен М.Шварц, Роберт П. Мехам. Редакторлар: Стивен М.Шварц, Роберт П. Мехам. Салымшылар: Стивен М.Шварц, Роберт П. Мехам. Баспагер: Academic Press, 1995 ж. ISBN 0-12-632310-0, ISBN 978-0-12-632310-8
- ^ а б c г. Уэбб, Р.Клинтон (қараша 2003). «Бұлшықеттің тегіс жиырылуы және релаксациясы». Физиология біліміндегі жетістіктер. 27 (4): 201–6. дои:10.1152 / адван.00025.2003. PMID 14627615.
- ^ Херли, Томас; Янг, Джи; т.б. (18.07.2007). «Ингибитор-2 арқылы ақуыз фосфатазасын 1 реттеудің құрылымдық негіздері». Дж.Биол. Хим. 282 (39): 28874–83. дои:10.1074 / jbc.m703472200. PMID 17636256.
- ^ Коэн, Патриция Т.В (15 қаңтар 2002). «Ақуызды фосфатаза 1-көптеген бағыттарға бағытталған». J ұялы ғылыми жұмыс. 115 (2): 780–4. PMID 11839776.
- ^ Фуджиока, М; Такахаси, N (1 сәуір, 1998). «Адамның миозиндік фосфатазасына бағытталған жаңа изоформ / регулятивті суббірлік (MYPT2): cDNA клондау, тіндердің көрінісі және хромосомалық картаға түсіру». Геномика. 49 (1): 325–41. дои:10.1006 / geno.1998.5222. PMID 9570949.
- ^ Гомпертс, Бастейн Д. (19 тамыз 2009). Сигналды беру: екінші басылым. Лондон: Academic Press. ISBN 978-0123694416.
- ^ Ши, Йигун (30 қазан, 2009). «Серин / треонинфосфатазалар: құрылым арқылы механизм». Ұяшық. 139 (3): 468–84. дои:10.1016 / j.cell.2009.10.006. PMID 19879837. S2CID 13903804. Алынған 9 наурыз 2015.
- ^ Ли, Эрнест Ю.К .; Чжан, Лифанг; т.б. (1999 ж. 15 наурыз). «Фосфорилаза фосфатаза: Ескі ферменттің жаңа көкжиектері». Биологиядағы шекаралар. 4 (1–3): 270–85. дои:10.2741 / Ли. PMID 10077543. Алынған 9 наурыз, 2015.
- ^ Ван, Юепенг; Риддик, Надин; т.б. (27.02.2009). «ROCK Isoform миозин фосфатазасын және тамырлардың тегіс бұлшықет жасушаларында жиырылғыштығын реттеу». Шеңбер Res. 104 (4): 531–40. дои:10.1161 / circresaha.108.188524. PMC 2649695. PMID 19131646.
- ^ а б Хромов, ЕС; Момотани, К .; т.б. (27.04.2012). «Миозинді жеңіл тізбекті фосфатазаны және cAMP / cGMP-индукцияланған асқазан-ішек тегіс бұлшықетін релаксациялаудың телокинмен қоздырылатын молекулалық механизмі». J Biol Chem. 287 (25): 20975–85. дои:10.1074 / jbc.m112.341479. PMC 3375521. PMID 22544752.
- ^ Сомло, Эндрю П .; Сомло, Аврил В. (10 қараша 1999). «G-ақуыздардың, ро-киназаның және ақуызды фосфатазаның миозин-бұлшықет пен бұлшық етсіз тегіс сигнал беруі». Физиология журналы. 522 (2): 177–85. дои:10.1111 / j.1469-7793.2000.t01-2-00177.x. PMC 2269761. PMID 10639096.
- ^ Агилар, Гектор; Митчелл, БФ (7 мамыр, 2010). «Жатырдың жиырылғыштығын реттейтін физиологиялық жолдар және молекулалық механизмдер». Адамның көбеюі туралы жаңарту. 16 (6): 725–44. дои:10.1093 / humupd / dmq016. PMID 20551073. Алынған 9 наурыз, 2015.
Әрі қарай оқу
- Пато М.Д., Адельштейн Р.С. (1983). «Күркетауық қабығының тегіс бұлшықетінен мультисубунитті фосфатазаны тазарту және сипаттамасы. Миозинді жеңіл тізбекті киназаға байланыстыратын кальмодулиннің депосфорилденуге әсері». Дж.Биол. Хим. 258 (11): 7047–54. PMID 6304072.
- Кимура К; т.б. (1996). «Миозинфосфатазаның Rho және Rho-ассоциацияланған киназа (Rho-kinase) арқылы реттелуі». Ғылым. 273 (5272): 245–248. Бибкод:1996Sci ... 273..245K. дои:10.1126 / ғылым.273.5272.245. PMID 8662509. S2CID 37249779.