Эндонуклеаз - Endonuclease
Эндонуклеаздар болып табылады ферменттер бұл фосфодиэстер байланысы ішінде полинуклеотид шынжыр. Кейбіреулері, мысалы дезоксирибонуклеаз I, ДНҚ-ны салыстырмалы түрде беймәлім түрде кесіп тастаңыз (бірізділікті ескермей), көбісі әдетте аталады шектеу эндонуклеазалар немесе шектеу ферменттері, тек нақты нуклеотидтер тізбегінде бөлінеді. Эндонуклеаздар ерекшеленеді экзонуклеазалар, ортаңғы (эндо) бөліктің орнына тану дәйектіліктерінің ұштарын бөледі. «Деп аталатын кейбір ферменттерэкзо-эндонуклеазалар«дегенмен, эндо және экзо тәрізді қасиеттерді көрсететін, тек нуклеаза функциясымен шектелмейді.[1] Дәлелдер эндонуклеаза белсенділігі экзонуклеаза белсенділігімен салыстырғанда артта қалушылықты көрсетеді.[2]
Шектеу ферменттері эндонуклеаздар болып табылады эубактериялар және архей белгілі бір ДНҚ тізбегін танитын.[3] Рестрикт ферменті арқылы бөлінуге танылған нуклеотидтер тізбегі рестрикция орны деп аталады. Әдетте, шектеу торабы a болады палиндромды ұзындығы шамамен төрт-алты нуклеотидтер. Рестрикциялық эндонуклеазалардың көпшілігі ДНҚ тізбегін біркелкі емес етіп бөліп, бірін-бірі толықтыратын бір-бірін толықтырады. Бұл ұштар будандастыру арқылы қайта қосыла алады және «жабысқақ ұштар» деп аталады. Жұптасқаннан кейін фрагменттердің фосфодиэфирлік байланыстары қосылуы мүмкін ДНҚ лигазы. Жүздеген эндонуклеазаның белгілі, олардың әрқайсысы әр түрлі шектеу орнына шабуыл жасайды. Бірдей эндонуклеазамен бөлінген ДНҚ фрагменттері ДНҚ-ның шығу тегіне қарамастан біріктірілуі мүмкін. Мұндай ДНҚ деп аталады рекомбинантты ДНҚ; Гендердің жаңа комбинацияларға қосылуынан пайда болған ДНҚ.[4] Шектеу эндонуклеазалары (шектеу ферменттері ) әсер ету механизмі бойынша үш санатқа, І типті, II типке және III типке бөлінеді. Бұл ферменттер жиі қолданылады генетикалық инженерия жасау рекомбинантты ДНҚ бактериялар, өсімдіктер немесе жануарлар жасушаларына енгізу үшін, сонымен қатар синтетикалық биология.[5] Ең танымал эндонуклеаздардың бірі - бұл Cas9.
Санаттар
Сайып келгенде, үш санат бар шектеу эндонуклеазалар салыстырмалы түрде белгілі бір тізбектердің бөлінуіне ықпал етеді. I және III типтері - бұл көп мүсінді кешендер, екеуін де қамтиды эндонуклеаздар және метилаза іс-шаралар. I тип тану ретінен шамамен 1000 базалық жұптан көп кездейсоқ учаскелерде бөлініп шығуы мүмкін және бұл энергия көзі ретінде АТФ қажет. II тип өзін сәл басқаша ұстайды және оны 1970 жылы Гамильтон Смит оқшаулаған. Олар эндонуклеаздардың қарапайым нұсқалары және олардың деградация процесінде АТФ қажет емес. Екінші типтегі рестрикциялық эндонуклеаздардың кейбір мысалдары жатады БамHI, ЭкоRI, ЭкоRV, ХинdIII, және ХаIII. III тип, алайда, ДНҚ-ны тану ретінен шамамен 25 базалық жұпта бөліп алады, сонымен қатар процесте АТФ қажет.[4]
Ескертпелер
Рестрикциялық эндонуклеаздар үшін жиі қолданылатын жазба[6] формада «VwxyZ «, қайда»Vwx«курсивпен, осы шектеу эндонуклеазы табылуы мүмкін түрдің бірінші әрпі және түрдің алғашқы екі әрпі, мысалы, Ішек таяқшасы, Эко, және Гемофилді тұмау, Хин. Одан кейін түрді немесе штаммды идентификациялауды көрсететін, міндетті емес, курсивтенбеген «y» символы, мысалы, ЭкоR үшін E. coli дәрілік тұрақтылықтың трансфер факторы RTF-1 бар штамдар,[6] ЭкоB үшін E. coli штамм B,[7] және Хинd үшін H. influenzae штамм г..[6] Сонымен, белгілі бір типте немесе штаммда бірнеше түрлі рестрикциялық эндонуклеазалар болған кезде, олар рим цифрларымен анықталады, демек, рестрикциялық эндонуклеазалар H. influenzae штамм d аталды ХинdI, ХинdII, ХинdIII және т.б. Тағы бір мысал: «ХаII «және»ХаIII »бактерияға қатысты Haemophilus aegyptius (штамм көрсетілмеген), шектеу эндонуклеазаларының саны сәйкесінше II және III саны.[4]:64–64 Молекулалық биологияда қолданылатын рестриктоздық ферменттер әдетте 4 - 8 базалық жұптың қысқа мақсатты тізбегін таниды. Мысалы, ЭкоRI ферменті 5 '- GAATTC - 3' тізбегін таниды және бөледі.[8]
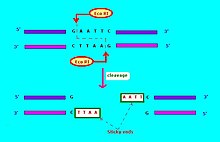
Шектеу эндонуклеазы бірнеше түрге бөлінеді. Шектеу эндонуклеазасы үшін әдетте тану орны мен бөліну сызбасы қажет (әдетте нуклеотидтік негіздер: A, C, G, T). Егер тану учаскесі бөліну сызбасының аймағынан тыс болса, онда шектеу эндонуклеазасы I типке жатқызылады. Егер тану реттілігі бөлу реттілігімен қабаттасса, онда шектеу эндонуклеазы рестрикциялық фермент II тип.
Әрі қарай талқылау
Стандартты dsDNA-ны (екі тізбекті ДНҚ), немесе ssDNA-ны (бір тізбекті ДНҚ), тіпті РНҚ-ны бөлетін шектеу эндонуклеазы табылуы мүмкін. Бұл талқылау тек dsDNA-мен шектелген; дегенмен, талқылауды келесіге дейін кеңейтуге болады:
- Стандартты dsDNA
- Стандартты емес ДНҚ
- Мереке қиылыстары
- Үш тізбекті ДНҚ, төрт тізбекті ДНҚ (G-квадруплекс )
- ДНҚ мен РНҚ-ның қос тізбекті будандары (бір тізбек - ДНҚ, екінші тізбек - РНҚ)[4]:72–73
- Синтетикалық немесе жасанды ДНҚ (мысалы, құрамында A, C, G, T басқа негіздері бар, жұмысына сілтеме жасайды Эрик Т. ). Синтетикамен зерттеу кодондар, С.Беннердің зерттеулеріне сілтеме жасап, полипептидтердегі амин қышқылын көбейтіп, протеомды немесе протеомика, П.Шульцтің зерттеуін қараңыз.[4]:3 тарау
Сонымен қатар, қазір синтетикалық немесе жасанды рестрикциялық эндонуклеазаларды құру бойынша зерттеулер жүргізілуде, әсіресе геном ішінде ерекше болатын тану орындарымен.
Шектеу эндонуклеазалары немесе шектеу ферменттері әдетте екі жолмен бөлінеді: ұшты немесе жабысқақ үлгілер. I типті шектеу эндонуклеазының мысалы.[4]:64
Сонымен қатар, бар ДНҚ / РНҚ-ға тән емес эндонуклеазалар сияқты табылған сияқты Serratia marcescens, олар dsDNA, ssDNA және РНҚ-ға әсер етеді.
ДНҚ-ны қалпына келтіру
Эндонуклеаздар ДНҚ-ны қалпына келтіруде маңызды рөл атқарады. AP эндонуклеазы, дәлірек айтсақ, ДНҚ кесіндісін тек қана АП учаскелерінде катализдейді, сондықтан ДНҚ-ны кейінгі экзиссияға, қалпына келтіру синтезіне және ДНҚ-ны байланыстыруға дайындайды. Мысалы, депуринация пайда болған кезде, бұл зақымдану негізі жоқ дезоксирибозды қант қалдырады.[9] AP эндонуклеазы бұл қантты таниды және осы аймақтағы ДНҚ-ны кесіп тастайды, содан кейін ДНҚ-ны қалпына келтіруге мүмкіндік береді.[10] E. coli жасушаларда екі AP эндонуклеазы бар: эндонуклеаза IV (эндоIV) және экзонуклеаза III (экзоІІІ), ал эукариоттарда бір ғана AP эндонуклеаза бар.[11]

Жалпы эндонуклеазалар
Төменде кең таралған прокариоттық және эукариоттық эндонуклеаздардың кестелері берілген.[12]
| Прокариоттық фермент | Дереккөз | Түсініктемелер |
|---|---|---|
| RecBCD энонуклеаз | E. coli | Ішінара ATP тәуелді; экзонуклеаза; рекомбинациялау және жөндеу кезіндегі функциялар |
| T7 эндонуклеазы (P00641) | фаг T7 (ген 3) | Көшіру үшін өте қажет; қос тізбекті ДНҚ-ға қарағанда бір тізбекті артықшылық |
| T4 эндонуклеаза II (P07059) | фаг T4 (denA) | 5'-dCMP - аяқталған олигонуклеотидтерді алу үшін -TpC- реттілігі; өнімнің тізбегінің ұзындығы шарттарға байланысты өзгереді |
| Bal 31 эндонуклеазы | P. espejiana | Сонымен қатар экзонуклеаза; дуплексті ДНҚ-ның 3 'және 5' ұштарын алып тастайды. Кем дегенде екі нуклеазаның қоспасы, жылдам және баяу.[13] |
| Эндонуклеаз I (эндо I; P25736) | E. coli (endA) | Периплазмалық орналасуы; өнімнің шынжырының орташа ұзындығы 7 құрайды; тРНҚ тежейді; қос тізбекті ДНҚ үзілісін жасайды; тРНҚ-мен комплекстелгенде ник түзеді; эндо I мутанттары қалыпты түрде өседі |
| Микрококкальды нуклеаза (P00644) | Стафилококк | 3'-P термини шығарады; Ca2 + қажет; сонымен қатар РНҚ-да әрекет етеді; жалғыз тізбекті ДНҚ және АТ-ға бай аймақтарды жақсы көреді |
| Эндонуклеаз II (эндо VI, экзо III; P09030) | E. coli (xthA) | AP учаскесінің жанындағы бөлшектеу; сонымен қатар 3 '-> 5' экзонуклеаза; фосфомоноэстераза 3'-P термининінде |
| Эукариоттық фермент | Дереккөз | Түсініктемелер |
| Нейроспораның эндонуклеазы[14] | Нейроспора крассасы, митохондриялар | Сонымен қатар РНҚ-да әрекет етеді. |
| S1 нуклеаза (P24021) | Aspergillus oryzae | Сонымен қатар РНҚ-да әрекет етеді |
| P1-нуклеаза (P24289) | Пенициллий цитрині | Сонымен қатар РНҚ-да әрекет етеді |
| Мун бұршағының нуклеазы Мен | бұршақ өскіндері | Сонымен қатар РНҚ-да әрекет етеді |
| Устилаго нуклеазы (Dnase I)[15] | Ustilago maydis | Сонымен қатар РНҚ-да әрекет етеді |
| Dnase I (P00639) | Сиырдың ұйқы безі | Өнімнің тізбегінің орташа ұзындығы - 4; Mn2 + қатысуымен қос тізбекті үзіліс жасайды |
| AP эндонуклеазы | Ядро, митохондрия | ДНҚ негізін кесіп алуды қалпына келтіру жолына қатысты |
| Эндо Р.[16] | HeLa жасушалары | GC сайттарына арналған |
Мутациялар
Ксеродерма пигментозасы ақаулы ультрафиолетке тән эндонуклеазадан туындаған сирек кездесетін, аутосомды-рецессивті ауру. Мутацияға ұшыраған науқастар күн сәулесінің әсерінен ДНҚ зақымдануын қалпына келтіре алмайды.[17]
Орақ жасушаларының анемиясы - бұл нүктелік мутациядан туындаған ауру. Мутациямен өзгерген реттілік нуклеотидтер тізбегін танитын эндонуклеаза MstII шектеуін тану орнын жояды.[18]
tRNA сплитингіндегі эндонуклеаза мутациясы понтоцеребелярлық гипоплазияны тудырады. Pontocerebellar гипоплазиясы (PCH) тРНҚ-сплайсинг эндонуклеаза кешенінің төрт түрлі суббірліктерінің үшеуіндегі мутациядан туындайтын нейродегенеративті аутосомды-рецессивті бұзылыстар тобын білдіреді.[19]
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ «Экзонуклеазалар мен эндонуклеаздардың қасиеттері». Жаңа Англия BioLabs. 2017. Алынған 21 мамыр, 2017.
- ^ Slor, Hanoch (1975 ж. 14 сәуір). «Экзонуклеазалар мен эндонуклеазалар арасындағы және гаплотомды және дипломотомды эндонуклеазалар арасындағы дифференциация, субстрат ретінде пластикалық депрессия плиталарының 3H-ДНҚ жабыны бар ұңғымаларын қолданады». Нуклеин қышқылдарын зерттеу. 2 (6): 897–903. дои:10.1093 / нар / 2.6.897. PMC 343476. PMID 167356.
- ^ Стивен Т.Килпатрик; Джоселин Э. Кребс; Левин, Бенджамин; Голдштейн, Эллиотт (2011). Левиннің гендері X. Бостон: Джонс пен Бартлетт. ISBN 978-0-7637-6632-0.
- ^ а б c г. e f Cox M, Nelson DR, Lehninger AL (2005). Линнинер биохимиясының принциптері. Сан-Франциско: В.Х. Фриман. бет.952. ISBN 978-0-7167-4339-2.
- ^ Саймон М (2010). Пайда болатын есептеу: Биоинформатикаға баса назар аудару. Нью-Йорк: Спрингер. б. 437. ISBN 978-1441919632.
- ^ а б c Смит, ХО; Nathans, D (15 желтоқсан 1973). «Бактериялардың иелерін модификациялау және шектеу жүйелері мен олардың ферменттеріне арналған ұсынылған номенклатура». Молекулалық биология журналы. 81 (3): 419–23. дои:10.1016/0022-2836(73)90152-6. PMID 4588280.
- ^ Рубин, РА; Модрич, П (25 қазан 1977). «EcoRI метилаза». Биологиялық химия журналы. 252 (20): 7265–72. PMID 332688.
- ^ Losick R, Watson JD, Baker TA, Bell S, Gann S, Levine MW (2008). Геннің молекулалық биологиясы. Сан-Франциско: Пирсон / Бенджамин Каммингс. ISBN 978-0-8053-9592-1.
- ^ Ellenberger T, Friedberg EC, Walker GS, Wolfram S, Wood RJ, Schultz R (2006). ДНҚ-ны қалпына келтіру және мутагенез. Вашингтон, ДС: ASM Press. ISBN 978-1-55581-319-2.
- ^ Alberts B (2002). Жасушаның молекулалық биологиясы. Нью-Йорк: Garland Science. ISBN 978-0-8153-3218-3.
- ^ Нишино Т, Морикава К (желтоқсан 2002). «ДНҚ-ны қалпына келтірудегі нуклеаздардың құрылымы мен қызметі: пішіні, ұсталуы және ДНҚ қайшысының қалақшасы». Онкоген. 21 (58): 9022–32. дои:10.1038 / sj.onc.1206135. PMID 12483517.
- ^ Таниа Бейкер; Корнберг, Артур (2005). ДНҚ репликациясы. Университет ғылымы. ISBN 978-1-891389-44-3.
- ^ Вэй, CF; Алианелл, Дж .; Бенсен, GH; Сұр HB, Jr (25 қараша 1983). «Alteromonas espejiana-дан BAL 31 нуклеазасының екі молекулалық түрін оқшаулау және салыстыру». Биологиялық химия журналы. 258 (22): 13506–12. PMID 6643438.
- ^ Линн, С; Леман, IR (10 маусым 1966). «Нейроспора крассасының митохондрияларынан эндонуклеаза». Биологиялық химия журналы. 241 (11): 2694–9. PMID 4287861.
- ^ Холломан, БҚ; Holliday, R (10 желтоқсан 1973). «Устилаго майдисінен алынған нуклеаза бойынша зерттеулер. I. Тазартылуы, қасиеттері және ферменттің рекомбинациясындағы әсері». Биологиялық химия журналы. 248 (23): 8107–13. PMID 4201782.
- ^ Готлиб, Дж; Музицка, N (5 шілде 1990). «HeLa эндонуклеазасының R. тазартылуы және сипаттамасы. G-ға тән сүтқоректілердің эндонуклеазасы». Биологиялық химия журналы. 265 (19): 10836–41. PMID 2358441.
- ^ Бір қарағанда медициналық биохимия. Нью-Йорк: Вили. 2012 жыл. ISBN 978-0-470-65451-4.
- ^ Ferrier DR, Champe PC, Harvey RP (2008). Биохимия. Филадельфия: Уолтерс Клювер / Липпинкотт Уильямс және Уилкинс. ISBN 978-0-7817-6960-0.
- ^ Budde BS, Namavar Y, Barth PG, Poll-The BT, Nürnberg G, Becker C, van Ruissen F, Weterman MA, Fluiter K, te Beek ET, Aronica E, van der Knaap MS, Höhne W, Toliat MR, Crow YJ. , Steinling M, Voit T, Roelenso F, Brussel W, Brockmann K, Kyllerman M, Boltshauser E, Hammersen G, Willemsen M, Basel-Vanagaite L, Krägeloh-Mann I, de Vries LS, Sztriha L, Muntoni F, Ferrie CD , Battini R, Hennekam RC, Grillo E, Beemer FA, Stoets LM, Wollnik B, Nürnberg P, Baas F (қыркүйек 2008). «tRNA сплитингтік эндонуклеаза мутациясы понтоцеребелярлық гипоплазияны тудырады». Нат. Генет. 40 (9): 1113–8. дои:10.1038 / нг.204. PMID 18711368.
