Тафамидис - Tafamidis - Wikipedia
 | |
| Клиникалық мәліметтер | |
|---|---|
| Сауда-саттық атаулары | Вындакель, Вындамакс және басқалар |
| AHFS /Drugs.com | Монография |
| Лицензия туралы мәліметтер | |
| Жүктілік санат | |
| Маршруттары әкімшілік | Ауыз арқылы |
| ATC коды | |
| Құқықтық мәртебе | |
| Құқықтық мәртебе | |
| Идентификаторлар | |
| |
| CAS нөмірі | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Чеби | |
| ЧЕМБЛ | |
| CompTox бақылау тақтасы (EPA) | |
| ECHA ақпарат картасы | 100.246.079 |
| Химиялық және физикалық мәліметтер | |
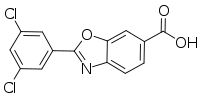
| Формула | C14H7Cl2NO3 |
| Молярлық масса | 308.11 г · моль−1 |
| 3D моделі (JSmol ) | |
| |
| |
| | |
Тафамидис, фирмалық атаумен сатылады Вындакель және Виндамакс басқалардың арасында,[4] жоғалтуды кейінге қалдыру үшін қолданылатын дәрі перифериялық жүйке ересектердегі функция отбасылық амилоидты полиневропатия (FAP).[5] Ол ақуызды тұрақтандыру арқылы жұмыс істейді транстриретин.[5] ФАП бар адамдарда бұл жіптер бөлініп, жүйкеге зиян келтіретін шоғырлар түзеді. Ол сондай-ақ жүрек ауруларын емдеу үшін қолданылады (кардиомиопатия ) транстриретинмен туындаған амилоидоздан (ATTR-CM) туындаған.[6]
АҚШ Азық-түлік және дәрі-дәрмектерді басқару (FDA) оны бірінші сыныптағы дәрі деп санайды.[7]
Медициналық қолдану
Тафамидис құнсыздануды кешіктіру үшін қолданылады перифериялық жүйке ересектердегі функция отбасылық амилоидты полиневропатия (FAP).[3][8][4] Ол алынды ауызбен.[3][4] Ол сонымен қатар транстриретинмен амилоидоздан (ATTR-CM) туындаған жүрек ауруын (кардиомиопатия) емдеу үшін қолданылады.[6]
Әйелдер оны қабылдаған кезде жүкті болмауы керек және оны қабылдаған кезде емшек емізбеуі керек. Бауыр трансплантациясын алған ФАП-мен ауыратын адамдар оны алмауы керек.[3]
Жағымсыз әсерлер
Клиникалық зерттеулерге қатысқан адамдардың 10% -дан астамында бір немесе бірнеше несеп жолдарының инфекциясы, қынап инфекциясы, іштің жоғарғы бөлігі ауырады немесе диарея болған.[3]
Өзара әрекеттесу
Тафамидис өзара әрекеттесетін сияқты емес цитохром P450 бірақ тежейді BCRP сондықтан метотрексат, розувастатин және иматинибті қоса, дәрілік заттардың қол жетімділігіне әсер етеді және тежейді OAT1 және OAT3 сондықтан NSAID-мен және сол тасымалдаушыларға тәуелді басқа дәрілермен өзара әрекеттесуі ықтимал.[3]
Фармакология
Тафамидис - бұл а фармакологиялық шаперон дұрыс бүктелген тұрақтандырады тетрамерикалық нысаны транстриретин (ТТР) ақуыз екеуінің бірімен байланысу арқылы тироксин -тетрамердің байланыстыратын орындары.[8] ФАП-мен ауыратын адамдарда жеке мономерлер тетрамерден алшақтап, қателеседі және жинақталады; агрегаттар жүйкеге зиян тигізеді.[8]
Плазмадағы ең жоғары концентрацияға дозаны қабылдағаннан кейін екі сағаттан соң жетеді; плазмада ол толығымен дерлік ақуыздармен байланысады. Клиникаға дейінгі мәліметтер негізінде оны метаболизденетін көрінеді глюкуронизация және өт арқылы шығарылады; адамдарда дозаның 59% -ы нәжіспен, ал шамамен 22% -ы несеппен қалпына келеді.[3]
Химия
Тафамидистің химиялық атауы - 2- (3,5-дихлорфенил) -1,3-бензоксазол-6-карбон қышқылы. Молекуланың екі кристалды және бір аморфты түрі бар; ол мүмкін кристалды формалардың бірінде дайындалады. Ол а ретінде сатылады меглумин тұз. Ол суда аз ериді.[9]
Тарих
Зертханасы Джеффери В.Келли кезінде Скриппс ғылыми-зерттеу институты 1990 жылдары ТТР фибрилінің түзілуін тежеудің жолдарын іздей бастады.[10]:210 Тафамидисті Келли тобы а дәрілік заттардың құрылымына негізделген құрылымы стратегия; химиялық құрылым бірінші рет 2003 жылы жарияланған.[11][12] 2003 жылы Келли FoldRx атты компанияны құрды Сюзан Линдквист MIT және Уайтхед Институты[12][13] және FoldRx дамыған 2010 жылдың басында Еуропада маркетингті мақұлдау туралы өтініш беру арқылы тафамидис.[11] FoldRx сатып алды Pfizer сол жылы.[11]
Тафамидилер мақұлдады Еуропалық дәрі-дәрмек агенттігі (EMA) 2011 жылғы қарашада, ересектердегі перифериялық нервтердің бұзылуын кешіктіру үшін транстриретинге байланысты тұқым қуалайтын амилоидоз.[8] АҚШ Азық-түлік және дәрі-дәрмектерді басқару (FDA) 2012 жылы маркетингті мақұлдау туралы өтінішті клиникалық сынақ функционалдық соңғы нүктеге негізделген тиімділікті көрсетпегендіктен бас тартты, ал FDA одан әрі клиникалық зерттеулер жүргізуді сұрады.[14] 2019 жылдың мамыр айында FDA транстиретинмен жүретін кардиомиопатияны (ATT-CM) емдеу үшін екі тафамидис препаратын, Vyndaqel (tafamidis meglumine) және Vyndamax (tafamidis) мақұлдады.[6] Препарат 2013 жылы Жапонияда мақұлданды; ондағы реттеуші органдар мақұлдауды тиімділіктің жақсырақ дәлелдерін көрсететін клиникалық зерттеулерге тәуелді етті.[15]
FDA бірінші кезекте 441 ересек пациенттердің клиникалық зерттеулерінің (NCT01994889) дәлелдемелеріне негізделген тафамидис меглуминді мақұлдады.[16] Сот ісі Бельгия, Бразилия, Канада, Чехия, Испания, Франция, Греция, Италия, Жапония, Нидерланды, Швеция, Ұлыбритания және АҚШ-тағы 60 алаңда өткізілді.[16]
Тафамидистің ATTR-CM емдеуге арналған артықшылықтары мен жанама әсерлерін бағалаған бір сынақ болды.[16] Сынақ кезінде ATTR ‑ CM бар науқастарға кездейсоқ түрде 30 ай ішінде тафамидис (немесе 20 немесе 80 мг) немесе плацебо қабылдауға тағайындалды.[16] Сынаққа қатысқан науқастардың 90% жуығы жүрек жеткіліксіздігіне қарсы басқа дәрілерді қабылдаған (емдеу стандартына сәйкес).[16]
EMA тафамидтерді жетім дәрі деп атады[5] және FDA tafamidis meglumine an есірткі.[17]
Қоғам және мәдениет
Құқықтық мәртебе
Тафамидис 2011 жылы Еуропалық Одақта, ал Жапонияда 2013 жылы медициналық қолдануға рұқсат етілген.[5][15] Бастапқыда ол АҚШ-та 2012 жылы қабылданбады, кейін 2019 жылы мақұлданды.[6] Америка Құрама Штаттарында транстиретинмен жүретін кардиомиопатияны (ATTR-CM) емдеуге екі дайындық - тафамидис меглумин және тафамидис мақұлданды.[6][18][16] Екі препараттың бірдей белсенді бөлігі бар - тафамидтер, бірақ олар миллиграммнан миллиграммаға ауыстырылмайды.[6]
Tafamidis (Vyndamax) және Tafamidis meglumine (Vyndaqel) Австралияда медициналық қолдануға 2020 жылдың наурыз айында мақұлданды.[19]
Әдебиеттер тізімі
- ^ а б «Vyndamax және Vyndaqel австралиялық дәрі-дәрмектерді тағайындау туралы шешім». Терапевтік тауарларды басқару (TGA). 17 шілде 2020. Алынған 16 тамыз 2020.
- ^ «Тафамидисті жүктілік кезінде қолдану». Drugs.com. 6 қыркүйек 2019. Алынған 16 тамыз 2020.
- ^ а б c г. e f ж «Vyndaqel 20 мг жұмсақ капсула - өнім сипаттамаларының қысқаша мазмұны». Электрондық дәрі-дәрмектер жиынтығы. Алынған 2 сәуір 2018.
- ^ а б c г. «Vyndaqel-tafamidis меглумин капсуласы, сұйықтық толтырылған Vyndamax-tafamidis капсуласы, сұйықтық толтырылған». DailyMed. 30 тамыз 2019. Алынған 24 қараша 2019.
- ^ а б c г. e «Vyndaqel EPAR». Еуропалық дәрі-дәрмек агенттігі (EMA). 16 қазан 2019. Алынған 24 қараша 2019.
- ^ а б c г. e f «FDA өте сирек кездесетін жүрек ауруы, транстриретинмен амилоидоздан туындаған жаңа емдеу әдістерін мақұлдайды». АҚШ Азық-түлік және дәрі-дәрмектерді басқару (FDA). 14 қыркүйек 2019. Мұрағатталды түпнұсқадан 2019 жылғы 14 қыркүйекте. Алынған 24 қараша 2019.
 Бұл мақалада осы қайнар көздегі мәтін енгізілген қоғамдық домен.
Бұл мақалада осы қайнар көздегі мәтін енгізілген қоғамдық домен. - ^ «Жаңа дәрі-дәрмектермен емдеу 2019». АҚШ-тың Азық-түлік және дәрі-дәрмек әкімшілігі. 31 желтоқсан 2019. Алынған 15 қыркүйек 2020.
- ^ а б c г. Саид, Г; Гриппон, С; Киркпатрик, П (1 наурыз 2012). «Тафамидис». Табиғи шолулар. Есірткіні табу. 11 (3): 185–6. дои:10.1038 / nrd3675. PMID 22378262.
- ^ «Бағалау туралы есеп: Vyndaqel tafamidis meglumine Процедура №.: EMEA / H / C / 002294» (PDF). EMA. 2011 жыл. EMA қараңыз индекс беті жаңартулар үшін.
- ^ Лабаудиниер, Ричард (2014). «9 тарау: ТТР отбасылық амилоидты полиневропатияны емдеу үшін тафамидилерді табу және дамыту». Прайда Дэвид С; Палмер, Майкл Дж (ред.). Жетім есірткі және сирек кездесетін аурулар. RSC есірткілерді табу сериясы № 38. Химия Корольдік Қоғамы. ISBN 978-1-84973-806-4.
- ^ а б c Джонс, Дэн (29 қазан 2010). «Ақуыздың қате күйін өзгерту». Табиғатқа шолулар Есірткінің ашылуы. 9 (11): 825–827. дои:10.1038 / nrd3316. PMID 21030987. S2CID 30702908.
- ^ а б Борман, Сту (25 қаңтар 2010). «Амилоидтарға шабуыл жасау». Химиялық және инженерлік жаңалықтар. 88 (4): 30–32. дои:10.1021 / cen-v088n004.p030.
- ^ Брезниц, Шири М .; О'Ши, Рори П .; Аллен, Томас Дж. (Наурыз 2008). «Аймақтық биокластерлерді дамытудағы университеттерді коммерциализациялау стратегиялары». Өнімді инновациялық басқару журналы. 25 (2): 129–142. дои:10.1111 / j.1540-5885.2008.00290.x.
- ^ Гроган, Кевин (19 маусым 2012). «FDA сирек кездесетін таффидидті Pfizer препаратынан бас тартады». Pharma Times.
- ^ а б «Талқылау нәтижелері туралы есеп» (PDF). Денсаулық сақтау, еңбек және әл-ауқат министрлігінің фармацевтикалық және тамақ қауіпсіздігі бюросының бағалау және лицензиялау бөлімі. 2 қыркүйек 2013 жыл.
- ^ а б c г. e f «Есірткіге арналған суреттер: Vyndaqel / Vyndamax». АҚШ Азық-түлік және дәрі-дәрмектерді басқару (FDA). 28 мамыр 2019. Мұрағатталды түпнұсқадан 2019 жылғы 19 желтоқсанда. Алынған 18 желтоқсан 2019.
 Бұл мақалада осы қайнар көздегі мәтін енгізілген қоғамдық домен.
Бұл мақалада осы қайнар көздегі мәтін енгізілген қоғамдық домен. - ^ «Tafamidis meglumine жетім дәрілік затты тағайындау және бекіту». АҚШ Азық-түлік және дәрі-дәрмектерді басқару (FDA). 3 мамыр 2019. Мұрағатталды түпнұсқадан 2019 жылғы 19 желтоқсанда. Алынған 18 желтоқсан 2019.
 Бұл мақалада осы қайнар көздегі мәтін енгізілген қоғамдық домен.
Бұл мақалада осы қайнар көздегі мәтін енгізілген қоғамдық домен. - ^ «Есірткіні мақұлдау пакеті: Vyndaquel & Vyndamax». АҚШ Азық-түлік және дәрі-дәрмектерді басқару (FDA). 13 маусым 2019. Алынған 24 қараша 2019.
 Бұл мақалада осы қайнар көздегі мәтін енгізілген қоғамдық домен.
Бұл мақалада осы қайнар көздегі мәтін енгізілген қоғамдық домен. - ^ «AusPAR: Tafamidis және Tafamidis meglumine». Терапевтік тауарларды басқару (TGA). 10 қыркүйек 2020. Алынған 23 қыркүйек 2020.
Әрі қарай оқу
- Адамс D (наурыз 2013). «Отбасылық амилоидты полиневропатияны емдеудегі соңғы жетістіктер». Ther Adv Neurol келіспеушілігі. 6 (2): 129–39. дои:10.1177/1756285612470192. PMC 3582309. PMID 23483184.
- Коэльо Т, Майя Л.Ф., Мартинс да Силва А және т.б. (Тамыз 2012). «Транстриретинді отбасылық амилоидты полиневропатияға арналған тафамидилер: рандомизацияланған, бақыланатын сынақ». Неврология. 79 (8): 785–92. дои:10.1212 / WNL.0b013e3182661eb1. PMC 4098875. PMID 22843282.
Сыртқы сілтемелер
- «Тафамидис». Есірткі туралы ақпарат порталы. АҚШ ұлттық медицина кітапханасы.
- «Tafamidis meglumine». Есірткі туралы ақпарат порталы. АҚШ ұлттық медицина кітапханасы.
