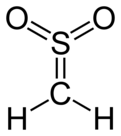
Сульфен - Sulfene
| |||
| Атаулар | |||
|---|---|---|---|
| Басқа атаулар Тиоформальдегид-S,S-диоксид[дәйексөз қажет ]; Метанетион диоксиді | |||
| Идентификаторлар | |||
| |||
3D моделі (JSmol ) | |||
| ChemSpider | |||
PubChem CID | |||
CompTox бақылау тақтасы (EPA) | |||
| |||
| |||
| Қасиеттері | |||
| CH 2СО 2 | |||
| Молярлық масса | 78,090 г моль−1 | ||
| Құрылым | |||
| С және S кезіндегі тригональды жазықтық | |||
Өзгеше белгіленбеген жағдайларды қоспағанда, олар үшін материалдар үшін деректер келтірілген стандартты күй (25 ° C [77 ° F], 100 кПа). | |||
| Infobox сілтемелері | |||
Сульфен өте реактивті химиялық қосылыс бірге формула H2C = SO2. Бұл ең қарапайым мүше сульфендер, қосылыстар тобы S,S- диоксидтері тиоальдегидтер және тиокетондар, және жалпы формула R бар2C = SO2.[1][2][3]
Дайындық
Сульфенді аралық ретінде дайындаудың алғашқы жалпы әдісі 1962 ж. Дейін бір уақытта баяндалған Гилберт Шторк[4] және Гюнтер Оптиздің,[5] жоюға қатысты сутегі хлориді бастап метансульфонилхлорид қолдану триэтиламин қатысуымен ан эмамин тұзақ құралы ретінде. А қалыптасуы титан Сульфеннің делдалдығына дәлел ретінде 1,1-диоксид туындысы алынды. Өте жоғары болғандықтан электрофильді сульфолдың сипаты, аминді қолдану қиынға соғады, өйткені олар сульфенді түзе алады қосымшалар. Аминді қолданудан аулақ болатын қарапайым балама десиляция триметилсилметансульфонилхлоридтің фторлы цезий ұстағыштардың қатысуымен.[6]
- (CH3)3SiCH2СО2Cl + CsF → [CH2= SO2] + (CH3)3SiF + CsCl
Сонымен қатар, сульфендерді алкилиден алмастырғышқа амидо алмастырғыштар орнату арқылы тұрақтандыруға болады. Төтенше жағдай тиокомидий диоксиді, онда жоспарлы амидо топтары бар.
 Тиореадиоксидтің құрылымы ((H2N)2АҚҰ2). Таңдалған қашықтықтар мен бұрыштар: rS = O = 1.49, рS = C = 1.85.1, рC-N = 1,31 Å, S = 112 ° айналасындағы бұрыштардың қосындысы.[7]
Тиореадиоксидтің құрылымы ((H2N)2АҚҰ2). Таңдалған қашықтықтар мен бұрыштар: rS = O = 1.49, рS = C = 1.85.1, рC-N = 1,31 Å, S = 112 ° айналасындағы бұрыштардың қосындысы.[7]
Реакциялар
Сульфендер эминдермен, инаминдермен және 1,3-циклопентадиендермен әрекеттеседі титандықтар, отызыншы және Дильс-Алдер сәйкесінше қосымшалар. Қатысуымен а хирал үшінші реттік амин кешені, бірнеше сульфенді трихлорацетальдегидпен ұстауға болады (хлор a- каталитикалық асимметриялық синтездесульфондар (төрт мүшелі сақина сульфонат эфирлері).[8] Сульфен метал-сутек байланыстарына ене алады.[9]
Сондай-ақ қараңыз
- Сульфин - H формуласымен байланысты функционалды топ2C = S = O
Әдебиеттер тізімі
- ^ IUPAC, Химиялық терминология жинағы, 2-ші басылым. («Алтын кітап») (1997). Желідегі түзетілген нұсқа: (2006–) «сульфендер ". дои:10.1351 / goldbook.S06095
- ^ Званенбург, Б (2004). «Тиоальдегидтер мен тиокетондардың S, S-диоксидтері (сульфендер және туындылар)». Ғылыми. Синт. 27: 123–134.
- ^ King, JF (1975). «Сульфендердің оралуы». Acc. Хим. Res. 8 (1): 10–17. дои:10.1021 / ar50085a002.
- ^ Лейлек, G; Боровиц, IJ (1962). «Төрт мүшелі сульфондар эминдерден және алифатикалық сульфонил галоидтерден». Дж. Хим. Soc. 84 (2): 313. дои:10.1021 / ja00861a042.
- ^ Опиц, Г; Adolph, H (1962). «Сульфеннің эминдерге циклоды шығарылымы». Angew. Хим. Int. Ред. 1 (2): 113–114. дои:10.1002 / anie.196201133.
- ^ Блок, Е; Аслам, М (1982). «Жаңа сульфен синтезі». Тетраэдр Летт. 23 (41): 4203–4206. дои:10.1016 / S0040-4039 (00) 88704-3.
- ^ Салливан, А. Харгривс (1962). «Тиокревин диоксидінің кристалды және молекулалық құрылымы». Acta Crystallogr. 15: 675–682. дои:10.1107 / S0365110X62001851.CS1 maint: авторлар параметрін қолданады (сілтеме)
- ^ Кох, ФМ; Питерс, Р (2011). «Льюис қышқылы / негізі катализденген [2 + 2] -Сульфендер мен альдегидтердің циклоды басылымы: Ширал сульфонил және сульфинил туындыларына жан-жақты кіру». Хим. EUR. Дж. 17: 3679–3692. дои:10.1002 / химия.201003542.
- ^ Инго-Питер Лоренц (1978 ж. Сәуір). «Металл-сутегі байланысына» сульфенді «енгізуді көрсету». Angew. Хим. Int. Ред. 17 (4): 285–286. дои:10.1002 / anie.197802851.