PAC-1 - PAC-1
Бұл мақалада ісікке қарсы молекулаға сілтеме жасалады, сонымен қатар a2iib3 интегринді активтендірудің бірдей аттас антиденесі емес
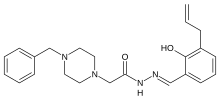 | |
| Идентификаторлар | |
|---|---|
| |
| CAS нөмірі | |
| PubChem CID | |
| IUPHAR / BPS | |
| ChemSpider | |
| UNII | |
| CompTox бақылау тақтасы (EPA) | |
| ECHA ақпарат картасы | 100.164.322 |
| Химиялық және физикалық мәліметтер | |
| Формула | C23H28N4O2 |
| Молярлық масса | 392.503 г · моль−1 |
| 3D моделі (JSmol ) | |
| |
| |
| (тексеру) | |
PAC-1 (бірінші саты активтендіретін қосылыс) - бұл селективті түрде индукциялайтын синтезделген химиялық қосылыс апоптоз, жылы қатерлі ісік жасушалар. Ол берілді есірткі 2016 жылы FDA мәртебесі.
Тарих
PAC-1 профессор Пол Хергенротер зертханасында табылды Урбанадағы Иллинойс университеті - Шампейн процесс барысында електен өтті ісікке қарсы потенциалға арналған көптеген химиялық заттар. Бұл молекула қатерлі ісік жасушаларына жеткізілгенде, «атқарушы» ақуызды белсендіру арқылы жасушаларға өзін-өзі жою туралы сигнал береді, прокаспаза-3. Содан кейін активтендірілген протеин протеині жасушаның механизмін бұзатын оқиғалар каскадын бастайды. 2011 жылы Vanquish Oncology Inc компаниясы PAC-1-ді адамның клиникалық сынақ кезеңіне көшіру үшін құрылды. 2013 жылы Vanquish компанияға миллиондаған долларлық періште салатынын жариялады. 2015 жылы қатерлі ісікке шалдыққан науқастарды тіркеу үшін PAC-1 клиникасының I кезеңі ашылды, ал 2016 жылы PAC-1 емделу үшін жетім дәріні тағайындады деп жарияланды. глиобластома FDA-мен, және 2017 жылдың соңында қайталанатын глиобластома немесе анапластикалық астроцитомасы бар науқастарды емдеуге арналған PAC-1 плюс темозоломидтің 1б фазасын сынақтан өткізу басталды.
Қимыл механизмі
Жасушаларда протеин-прокаспаза-3 протеині - каспаза-3 белсенді емес түрінде сақталады. Осылайша, жасуша қазірдің өзінде бар ақуызды белсендіру арқылы апоптоздан тез өтеді. Бұл белсенді емес пішін а деп аталады зимоген. Прокаспаза-3 мырыштың төмен деңгейімен тежелетіні белгілі. PAC-1 мырышты хелирлеу арқылы прокаспаза-3-ті белсендіреді, осылайша мырышпен байланысты тежелуді жеңілдетеді. Бұл прокаспаза-3 белсенді ферменті болуға мүмкіндік береді, содан кейін ол прокаспаза-3 басқа молекуласын белсенді каспаза-3-ке дейін бөлшектей алады. Каспаза-3 жасушадағы басқа пропазасаза-3 молекулаларын одан әрі белсендіре алады, бұл каспаза-3 концентрациясының экспоненциалды жоғарылауын тудырады. PAC-1 бұл процесті жеңілдетеді және жасушаның тез апоптозға ұшырауын тудырады.[1]
PAC-1-ге тікелей прокаспаза-3 белсендіру режимін басқа зертханалар растаған: 2013 жылы Мегеней зертханасы кардиомиоциттердегі каспаза-3 рөлі туралы зерттеулер барысында,[2] 2014 жылы Wu зертханасында PAC-1 және туындыларының қатерлі ісікке қарсы белсенділігі мен әсер ету режимі туралы кең зерттеуде,[3] және 2015 жылы Ганди зертханасында PAC-1 және B-PAC-1 туындыларының емдеу әлеуетін зерттеуде созылмалы лимфолейкоз (CLL).[4]
Нокаут жасушаларымен жүргізілген зерттеулер прокаспаза-7-нің PAC-1 үшін қайталама немесе балама нысана ретінде маңыздылығын, әсіресе прокаспаза-3 болмаған кезде ұсынды. Мысалы, тышқанның эмбрионды фибробласттарын (MEFs) қолданған тәжірибелер CASP3 және CASP7 гендерінің екі рет нокаутқа ұшырауы PAC-1 класының қосылыстарының проапоптотикалық әсеріне сезімтал емес жасушаларға әкелетінін және CASP3 немесе CASP7-ді тағы бір рет қағып тастайтындығын көрсетеді. осы жасушаларды ПАС-1 типті қосылыстарға сезімтал етеді.[5] CASP3-ті CRISPR жоюымен қатерлі ісік жасушаларының сызықтарын қолдану арқылы жасалған соңғы тәжірибелер де осы нәтижеге сәйкес келеді.[6] Прокаспаза-7-ді PAC-1-мен активтендіру биохимиялық мәліметтерге сәйкес келеді, дегенмен функционалды пропазасаза-3 бар жасушалардағы прокаспаза-7 мақсатының салыстырмалы маңыздылығы белгісіз.
Прокаспаза-3 организмнің көптеген жасушаларында болатындықтан, селективтік проблема туындайды. Алайда, көптеген онкологиялық ауруларда, соның ішінде белгілі бір түрлерде екендігі көрсетілген нейробластомалар, лимфомалар, лейкоздар, меланомалар, және бауыр қатерлі ісіктері, прокаспаза-3 жоғары концентрацияда болады.[1] Мысалы, өкпенің қатерлі ісігі жасушаларында прокаспаза-3 қалыпты жасушаларға қарағанда 1000 есе көп болуы мүмкін.[1] Сондықтан дозаны бақылау арқылы қалыпты және қатерлі ісік жасушалары арасында селективтілікке қол жеткізуге болады.
PAC-1 дербес белсенділігімен қатар, әр түрлі мақұлданған онкологиялық препараттармен синергияланатыны дәлелденген, мысалы BRAF және МЕК меланоманың тышқан модельдеріндегі ингибиторлар,[7] сияқты кәдімгі химиотерапиялық агенттермен доксорубицин лимфома және метастатикалық, соның ішінде спонтанды қатерлі ісіктері бар үй жануарлары итінде остеосаркома,[8] және бірге темозоломид табиғи түрде кездесетін үй жануарлары иттерінде глиома.[9]
Vanquish Oncology 2015 жылдың басында басталатын қатерлі ісікке шалдыққандарға арналған I кезеңдегі адамның клиникалық сынақтарын бастауға ниет білдірді және шынымен де PAC-1 1 кезеңінің сынағы 2015 жылдың ақпан айында тіркелу үшін ашылды (NCT02355535). Бұл сот процесі Иллинойс университетінің Чикагодағы онкологиялық орталықта өткізіліп жатыр Sidney Kimmel онкологиялық орталығы кезінде Джон Хопкинс, және Сент-Полдағы аймақтық ауруханада, MN. PAC-1 плюс темозоломидтің 1b фазалық сынағы 2017 жылдың соңында дәл осы үш алаңда ашылды (NCT03332355); осы сынаққа стандартты бірінші қатардағы терапиядан кейінгі прогрессиядан кейін жоғары дәрежелі глиома (глиобластома мульти формалы (GBM) немесе анапластикалық астроцитома) бар науқастар қатыса алады.
Жануарларға арналған сынақтар
PAC-1 клиникаға барған ерекше жолымен ерекшеленеді, өйткені бұл адам клиникалық зерттеуінің алғышарты ретінде спонтанды қатерлі ісігі бар үй жануарлары иттерінде қатал бағаланатын жалғыз қатерлі ісікке қарсы дәрі болуы мүмкін. 2010 жылы зерттеу PAC-1 иттер үшін қауіпсіз екенін көрсетті, және сол жылы жарияланған екінші зерттеуде PAC-1 туындысының (S-PAC-1 деп аталатын) клиникасының I кезеңінде жақсы төзімділігі туралы хабарлады. лимфомасы бар иттер. Жақында, PAC-1 осы бір агентті белсенділіктен басқа, қатерлі ісікке қарсы дәрі-дәрмектермен күшті синергияны көрсетті, мысалы лимфома және метастатикалық остеосаркомамен үй жануарларын иттерді емдеуде доксорубицинмен,[8] және үй жануарларын иттерді өздігінен глиомамен емдеуде темозоломидпен.[9]
Адамның клиникалық сынақтары
PAC-1 адамның келесі клиникалық сынақтарында сыналған немесе қазір тексерілуде:
- NCT02355535 - Қатерлі ісік ауруларын емдеудегі белсенді компонент-1 (PAC-1) - 1 компонент
- NCT03332355 - Қатерлі ісік ауруларын емдеудегі белсенді қосылыстар-1 (PAC-1) - 2 компонент
- NCT03927248 - Бүйректің отқа төзімді, метастатикалық қатерлі ісігін емдеуге арналған PAC-1
Әдебиеттер тізімі
- ^ а б c Putt KS, Chen GW, Pearson JM, Sandhorst JS, Hoagland MS, Kwon JT, Hwang SK, Jin H, Churchwell MI, Cho MH, Doerge DR, Helferich WG, Hergenrother PJ (2006). «Прокаспаза-3 каспаза-3-ке дейін кіші молекулалы активтендіру, дертке қарсы жеке стратегия ретінде l». Табиғи химиялық биология. 2 (10): 543–50. дои:10.1038 / nchembio814. PMID 16936720.
- ^ Putinski C, Abdul-Ghani M, Stiles R, Brunette S, Dick SA, Fernando P, Megeney LA (2013). «Ішкі делдалдық каспазаны активтендіру кардиомиоциттердің гипертрофиясы үшін маңызды». Ұлттық ғылым академиясының материалдары. 110 (43): E4079-87. дои:10.1073 / pnas.1315587110. PMC 3808644. PMID 24101493.
- ^ Ван Ф, Ван Л, Чжао Ю, Ли Ю, Пинг Г, Сяо С, Чен К, Чжу В, Гонг П, Ян Дж, Ву С (2014). «Прокаспаза-3 жаңа кіші молекулалы активаторы рак клеткаларында апоптоз тудырады және адамның кеуде, бауыр және өт қабының қатерлі ісігі ксенографтарында ісіктің өсуін азайтады». Молекулалық онкология. 8 (8): 1640–1652. дои:10.1016 / j.molonc.2014.06.015. PMC 5528581.
- ^ Patel V, Balakrishnan K, Keatin MJ, Wierda WG, Gandi V (2015). «Професпаздардың протеиндерінің экспрессиясы және оларды созылмалы лимфоцитарлы лейкемия жасушаларында прокаспазаны белсендіретін қосылыспен белсендіру». Қан. 125 (7): 1126–1136. дои:10.1182 / қан-2014-01-546796. PMC 4326772. PMID 25538042.
- ^ Sarkar A, Balakrishnan K, Chen J, Patel V, Neelapu SS, McMurray JS, Gandi V (2016). «В-жасушалық лимфомадағы B-PAC-1 активтендіретін қосылыстың прокаспазаның Zn хелаттауының молекулалық дәлелі». Oncotarget. 7 (3): 3461–3476. дои:10.18632 / oncotarget.6505. PMC 4823120. PMID 26658105.
- ^ Лин А, Джулиано С, Палладино А, Джон К, Абрамович С, Юань М, Саусвилл Е, Луков Д, Лю Л, Чаит А, Галлуцзо З, Такер С, Шелцер J (2019). «Мақсаттан тыс уыттылық - бұл клиникалық зерттеулерден өтіп жатқан қатерлі ісікке қарсы дәрі-дәрмектердің кең таралған механизмі» Ғылыми аударма. 11 (509): eaaw8412. дои:10.1126 / scitranslmed.aaw8412. PMID 31511426.
- ^ Peh J, Fan TM, Wycislo KL, Roth HS, Hergenrother PJ (2016). «Вемурафениб пен Прокаспаза-3 активтендіруінің үйлесуі мутантты BRAF меланомаларында синергетикалық болып табылады». Молекулалық қатерлі ісік терапиясы. 15: 1859–1869. дои:10.1158 / 1535-7163. MCT-16-0025. PMC 4975653.
- ^ а б Ботам RC, Roth HS, Book AP, Roady PJ, Fan TM, Hergenrother, PJ (2016). «Шағын молекулалы Прокаспаза-3 белсенділігі қатерлі ісік ауруын әртүрлі химиотерапевтикалық емдеуге сезімтал етеді». ACS Central Science. 2: 545–559. дои:10.1021 / acscentsci.6b00165. PMC 4999974.
- ^ а б Джоши А.Д., Ботам RC, Рот ХС, Шлейн Л.Ж., Рот ХС, Мангравити А, Бородовский А, Тайлер Б, Джослин С, Лупер Дж.С., Поделл М, Фан ТМ, Хергенротер П.Ж., Риггинс Г.Ж. (2017). «Прокаспаза-3 активаторымен және темозоломидпен синергетикалық және мақсатты терапия глиома кеміргіштер модельдерінде өмір сүруді ұзартады және иттердің қатерлі глиомасы бар науқастарды емдеу үшін қолайлы». Oncotarget. 8: 80124–80138. дои:10.18632 / oncotarget.19085. PMC 5655184.
- Петерсон, П.П .; Гуд, Д.Р .; West, D. C .; Рэмси, К. Н .; Ли, Дж. Дж .; Hergenrother, P. J. (2009). «PAC-1 прокаспаза-3-ті in vitro мырыш арқылы тежелген ингибитті жеңілдетеді». Дж.Мол. Биол. 388 (1): 144–158. дои:10.1016 / j.jmb.2009.03.003. PMC 2714579. PMID 19281821.
- Петерсон, П.П .; Хсу, Д. С .; Гуд, Д.Р .; Новотный, Дж .; Тоттен, Р.К. Хергенротер (2009). «Procaspase-3 активтендіруі қатерлі ісікке қарсы стратегия ретінде: PAC-1 құрылымдық-белсенділік байланысы және оны Caspase-3-пен жасушалық бірлестіру». Дж. Мед. Хим. 52 (18): 5721–5731. дои:10.1021 / jm900722z. PMC 2749958. PMID 19708658.
- Лукас, П .; Шмит, Дж. М .; Петерсон, П.П .; West, D. C .; Хсу, Д. С .; Новотный, Дж .; Дирикул, Л .; Деорге, Д.Р .; Гаррет, Л.Д .; т.б. (2011). «Прокаспаза-3 преференциалды ұсақ молекулалық активаторы, сау иттерде PAC-1 үшін ісікке қарсы дозалау режимінің фармакокинетикасы және туындысы». Инвестиция. Жаңа есірткі. 29 (5): 901–911. дои:10.1007 / s10637-010-9445-z. PMC 3182491. PMID 20499133.
- Петерсон, П.П .; Хсу, Д. С .; Новотный, Дж .; West, D. C .; Ким, Д .; Шмит, Дж. М .; Дириколу, Л .; Гергенротер, П. Дж .; Фан, Т.М .; т.б. (2010). «Уытты емес прокаспаза-3 белсенділендіретін қосылыстың ашылуы және кинологияға дейінгі клиникалық бағасы». Қатерлі ісік ауруы. 70 (18): 7232–7241. дои:10.1158 / 0008-5472.-10-0766. PMC 3113694. PMID 20823163.
- West, D. C .; Цин, Ю .; Петерсон, П.П .; Томас, Д. Л .; Палчаудхури, Р.П .; Моррисон, К. С .; Лукас, П .; Палмер, А. Е .; Фан, Т.М .; т.б. (2012). «Прокаспаза-3 белсендіргіш қосылыстарының рак клеткаларының өлім индукциясындағы дифференциалды әсері». Мол. Фармацевтика. 9: 1425–1434.
- Ботэм, Р. С .; Фан, Т.М .; Мен, мен .; Борст, Л.Б; Дириколу, Л .; Hergenrother, P. J. (2014). «Прокаспаза-3-тің екі кіші молекулалық бағыттылығы зимогенді белсендіруді және қатерлі ісікке қарсы белсенділікті күрт күшейтеді». Дж. Хим. Soc. 136 (4): 1312–1319. дои:10.1021 / ja4124303. PMC 3954530. PMID 24383395.
Сыртқы сілтемелер
- Қатерлі ісік жасушасы табылды. BBC News 27 тамыз 2006 ж.
- Қатерлі ісік жасушалары 'мәңгі өмір сүре алады'. BBC News 29 сәуір 2004 ж.
- Vanquish онкологиясы
- Періштелер инвестициялары PAC-1-ді алға жылжытуға көмектеседі
- FDA глиомаға арналған PAC-1 жетім дәрі-дәрмектерді тағайындайды
- Адамның қатерлі ісік ауруына шалдыққандардағы PAC-1 клиникалық зерттеуінің 1 кезеңі kliniktrials.gov
