Жеңіл парақтың люминесценттік микроскопиясы - Light sheet fluorescence microscopy - Wikipedia

Жеңіл парақтың люминесценттік микроскопиясы (LSFM) Бұл флуоресценттік микроскопия аралықтан жоғарыға дейін техника[1] оптикалық ажыратымдылық, бірақ жақсы оптикалық секциялар мүмкіндіктер мен жоғары жылдамдық. Айырмашылығы эпифлуоресценттік микроскопия тек үлгінің жіңішке тілімі (әдетте бірнеше жүз нанометрден бірнеше микрометрге дейін) бақылау бағытына перпендикулярлы жарықтандырылады. Жарықтандыру үшін, а лазер ақшыл парақ қолданылады, яғни лазерлік сәуле, ол тек бір бағытқа бағытталған (мысалы, цилиндрлік линзаны қолдану арқылы). Екінші әдіс жарық парағын жасау үшін бір бағытта сканерленген дөңгелек сәулені қолданады. Тек іс жүзінде бақыланатын бөлім жарықтандырылғандықтан, бұл әдіс тірі үлгіні тудыратын фотодығуды және стрессті төмендетеді. Сондай-ақ, оптикалық секцияның жақсы мүмкіндігі фондық сигналды азайтады және осылайша салыстыруға болатын жоғары контрастты кескіндер жасайды конфокальды микроскопия. LSFM үлгілерді нүктенің орнына жарықтың жазықтығын қолдану арқылы сканерлейтіндіктен (конфокальды микроскопиядағыдай), суреттерді нүктелік сканерлеу әдістеріне қарағанда 100-ден 1000 есе жылдамдықпен ала алады.

Бұл әдіс қолданылады жасуша биологиясы[2] және бұзылмаған, көбінесе химиялық тазартылған мүшелерді, эмбриондарды және организмдерді микроскопиялау үшін.[3]
1994 жылдан бастап LSFM келесідей дамыды ортогоналды жазықтық флуоресценциясының оптикалық қимасы микроскопия немесе томография (OPFOS)[4] негізінен үлкен үлгілерге және кейінірек бір реттік жазықтықты жарықтандыру микроскопиясы (SPIM) сонымен қатар ішкі ұяшық ажыратымдылығымен.[5] Бұл флюоресценттік микроскопияға жарықтандыру схемасын енгізді, ол қазірдің өзінде сәтті қолданылып келді қараңғы өрісті микроскопиялау атымен ультрамикроскопия.[6]
LSFM орнату
Негізгі орнату

Микроскопияның бұл түрінде,[7] жарықтандыру бақылау бағытына перпендикуляр түрде жасалады (мақаланың жоғарғы жағындағы сызбалық суретті қараңыз). А кеңейтілген сәулесі лазер цилиндрлік линзамен немесе а тіркесімімен тек бір бағытта бағытталған цилиндрлік линза және а микроскоптың объективі өйткені соңғысы оптикалық сапада және одан да жоғары деңгейде қол жетімді сандық апертура біріншісіне қарағанда. Осылайша фокустық аймақта жұқа жарық парағы жасалады, оны флуоресценцияны қоздыру үшін тек үлгінің жіңішке кесіндісінде (әдетте бірнеше микрометр жұқа) жасайды.
The флуоресценттік жарық содан кейін жарық парағынан шығарылатын стандартты микроскоп объективімен перпендикуляр түрде жиналады және бейнелеу сенсорына проекцияланады (әдетте ПЗС, электрондарды көбейту ПЗС немесе CMOS камерасы ). Қозу оптика / жарық парағына жеткілікті орын беру үшін жұмыс қашықтығы жоғары бақылау мақсаты қолданылады. LSFM көпшілігінде анықтау мақсаты, кейде қозу мақсаты сынама буферіне толығымен батырылады, сондықтан әдетте сынама және қозу / анықтау оптикасы буфермен толтырылған үлгі камерасына енгізіледі, оны қоршаған орта жағдайын бақылау үшін де қолдануға болады ( температура, көмірқышқыл газының деңгейі ...) өлшеу кезінде. The LSFM-ге үлгілік монтаждау төменде толығырақ сипатталған.
Сурет қалыптастыру үшін қоздыру бағдаршамы да, анықтау оптикасының фокустық жазықтығы да сәйкес келуі керек болғандықтан, үлгінің әр түрлі бөліктерін фокустауды анықтау мақсатын аудару арқылы жасау мүмкін емес, бірақ әдетте оның орнына бүкіл үлгі аударылып, айналдырылады.
LSFM негізгі идеясының кеңейтімдері
Соңғы жылдары осы схеманың бірнеше кеңейтімдері әзірленді:
- Екі қарама-қарсы тарайтын жарық парақтарын пайдалану көлеңкелену сияқты типтік SPIM артефактілерін азайтуға көмектеседі (жоғарыдағы бірінші z-стекті қараңыз)[8]
- Жарық парақтарының қарсы таралуына қосымша, екі қарама-қарсы жақтан анықтайтын қондырғы 2012 жылы ұсынылған.[9][10] Бұл үлгіні тезірек толық көлемде қайта құру үшін z- және айналу стектерін өлшеуге мүмкіндік береді.
- Жарық парағын сонымен қатар қалыпты лазерлік фокусты жоғары және төмен сканерлеу арқылы жасауға болады.[11] Бұл сонымен қатар өзін-өзі қалпына келтіретін сәулелерді пайдалануға мүмкіндік береді (мысалы бессель сәулелері немесе Ұшақ сәулелері ) жарық парағының қалың үлгілерге енуін жақсартатын жарықтандыру үшін, өйткені шашыраудың жарық парағына кері әсері азаяды.[12][13][14] Бұл өзін-өзі қалпына келтіретін сәулелерді әлсірету-компенсациялау әдістерін қолдана отырып, қарқындылықтың жоғалуына қарсы тұру үшін өзгертуге болады, әрі қалың сынамалардан жиналған сигналды одан әрі арттырады.[15]
- Жылы қиғаш жазықтықтағы микроскопия (OPM)[16] анықтау мақсаты жарық парағын жасау үшін де қолданылады: жарық парағы енді осы мақсаттан шамамен 60 ° бұрышпен шығарылады. Қосымша оптика бірдей бұрышпен анықтау үшін қолданылатын фокустық жазықтықты еңкейту үшін қолданылады.
- LSFM сонымен бірге біріктірілді екі фотонды (2Р) қозу, бұл қалың және шашыраңқы үлгілерге енуді жақсартады.[17] Инфрақызыл толқын ұзындығында 2Р қоздырғышын қолдану мидың бейнелеу тәжірибелерінде көзге көрінетін тітіркендіргіштерге жауап беретін көк көзге көрінетін толқын ұзындықтарындағы 1Р қозуды ауыстыру үшін қолданылған.[18]
- SPIM сияқты әдістермен біріктірілуі мүмкін флуоресценттік корреляциялық спектроскопия, флуоресцентті бөлшектердің кеңістіктегі шешілген қозғалғыштығын өлшеуге мүмкіндік беру үшін (мысалы, флуоресцентті моншақ, кванттық нүктелер немесе флуоресцентті таңбаланған ақуыздар) тірі биологиялық үлгілердің ішінде.[19][20]
- Флуоресценцияның өмір сүру уақытының картасын өлшеуге мүмкіндік беретін, суретті күшейтетін қақпақты камерамен SPIM микроскопының тіркесімі туралы хабарлады (флуоресцентті өмір бойы бейнелеу, FLIM).[21]
- LSFM біріктірілді супер ажыратымдылықтағы микроскопия оның шешімін Аббе шегінен тыс жақсарту әдістері.[22][23] Сондай-ақ ынталандырылған эмиссияның сарқылуының микроскопиясы (STED) және SPIM жарық көрді, бұл STED әсерінен жарық парағының қалыңдығын төмендетеді.[24] Тарауын қараңыз LSFM шешімінің күші төменде.
- LSFM барлық мақсаттарға, тіпті кеңістіктік ажыратымдылық пен флуоресценцияны анықтау тиімділігін арттыру үшін сандық апертурасы бар, липсель негізінде, майды батыруға арналған мақсаттармен үйлесімді етіп өзгертілді.[25] Бұл әдіс жарық парағын анықтау мақсатына қатысты шыны жабындардың бетінде жарық парағының пайда болуын қамтамасыз ету үшін дәл бұрышпен еңкейтуді қамтиды.
- LSFM біріктірілді Адаптивті оптика 2012 жылы 350 мм тереңдіктегі қалың және біртекті емес үлгілерде бейнелеу тереңдігін жақсарту әдістері.[26] Shack Hartmann толқындық сенсоры анықтау жолына орналастырылған және бағыттаушы жұлдыздар кері байланыс циклында қолданылады. Өзінің тезисінде[27] автор үлгіде келтірілген ауытқуларды түзету үшін LSFM жарықтандыру және анықтау жолында адаптивті оптика болу артықшылығын талқылады.
Үлгіні монтаждау

LSFM-де жарық сәулелерін бөлу және анықтау қиғаш жазықтықтағы микроскопия ) мамандандырылған монтаждау әдістеріне қажеттілік туғызады. Бүгінгі күні көптеген LSFM жарықтандырғыштар мен жарықтандырғыштар көлденең жазықтықта жататындай етіп салынған (жоғарыдағы суреттерді қараңыз), осылайша үлгі әдетте жоғарыдан үлгі камерасына ілінеді немесе үлгінің ішіндегі тік тірекке тіреледі камера. Барлық үлгілерді монтаждаудың бірнеше әдістері әзірленді:
- Тұрақты (және ықтимал тазартылған) үлгілерді қарапайым тіреуішке немесе ұстағышқа жабыстыруға болады және кескіндеме кезінде олардың шешімінде қалуы мүмкін.
- Ірі тірі организмдер әдетте тыныштандырылып, жоғарыдан үлгі камерасына ілінген (шыны немесе пластикалық) капиллярдан шығарылған жұмсақ гель цилиндріне орнатылады.
- Жабысқақ жасушаларды үлгі камерасында ілулі тұрған кішкене шыны табақтарда өсіруге болады.
- Өсімдікті өсіру ортасы бар мөлдір гельдерде өсіруге болады. Гельдер кескіндеу кезінде кесіліп тасталады, сондықтан олар шашырау және сіңіру арқылы жарық парағы мен кескін сапасын төмендетпейді.[28]
- Сұйық үлгілер (мысалы үшін флуоресценттік корреляциялық спектроскопия ) жұқа пластик фольгадан жасалған кішкене пакеттерге салынуы мүмкін сыну көрсеткіші үлгі камерасындағы қоршаған иммерсиялық ортаның[20]
Үлгі стандартты микроскопиядағыдай орнатылатын кейбір LSFM құралдары дамыды (мысалы, жасушалар төменгі жағында көлденең өседі) петриден жасалған тағам ) және қоздыру және анықтау оптикасы жоғарыдан тік жазықтықта салынған. Бұл сонымен қатар LSFM стандартын біріктіруге мүмкіндік береді төңкерілген микроскоп және мамандандырылған монтаждау процедураларына қойылатын талаптардан аулақ болады.[19][29][30][31]
LSFM кескін қасиеттері
Кескіннің типтік режимдері
Көптеген LSFM үлгілерді кескін жазықтығы арқылы жылжыту арқылы үлгінің 3D кескіндерін жасау үшін қолданылады. Егер үлгі кескін сенсорының көру аймағынан үлкен болса, үлгіні де бүйірге ауыстыруға тура келеді. Альтернативті тәсіл - сурет стегін құру үшін кескін жазықтығын үлгі арқылы жылжыту.[31]
Ұзақ эксперименттерді, мысалы, әр 10 секунд сайын -10 мин сайын жазылған стектермен жүргізуге болады. Бұл уақыт бойынша өзгерістерді 3D форматында немесе 4D микроскопиясы деп аталатын зерттеуге мүмкіндік береді.
Кескін алынғаннан кейін кескіннің әртүрлі стектері болады тіркелген бір 3D жиынтығын құру үшін. Мақсат рөлдерін өзара ауыстыру арқылы іріктеменің бірнеше көрінісін жинауға болады[31] немесе үлгіні айналдыру арқылы.[8] Бірнеше көрініске ие болу бір стекке қарағанда көбірек ақпарат береді; мысалы, үлгінің кейбір бөліктерінің окклюзиясын жеңуге болады. Сондай-ақ, бірнеше көріністер төменде сипатталғандай нашар осьтік ажыратымдылықты жеңе отырып, кескіннің 3D ажыратымдылығын жақсартады.
Сондай-ақ, кейбір зерттеулер SPIM-ді үлгінің тек бір кесіндісін бейнелеу үшін қолданады, бірақ уақытша ажыратымдылығы анағұрлым жоғары. Бұл мысалы. нақты уақыт режимінде зебра балық эмбрионының соғып тұрған жүрегін бақылау.[32] Үлгіге жылдам аударма кезеңдерімен бірге жылдамдықты 3D бөлшектерін қадағалау жүзеге асырылды.[33]
Ажыратымдылық күші
SPIM-нің бүйірлік ажыратымдылығы стандартты (epi) флуоресценттік микроскоппен салыстыруға болады, өйткені ол анықтау мақсатымен және анықталған жарықтың толқын ұзындығымен толық анықталады (қараңыз) Abbe limit ). Мысалы. жасыл спектрлік аймақта 525 нм шамасында анықтау үшін 250-500 нм ажыратымдылыққа қол жеткізуге болады.[7] Осьтік ажыратымдылық бүйірден гөрі нашар (шамамен 4 есе), бірақ оны жұқа жарық парағын қолдану арқылы жақсартуға болады, бұл жағдайда изотропты ажыратымдылық мүмкін.[19] Жіңішке жеңіл парақтар тек шағын аймақта жұқа болады (үшін Гаусс сәулелері ) немесе басқадай мамандандырылған сәулелік профильдер, мысалы, Бессель сәулелері қолданылуы керек (қосымша күрделіліктен басқа, мұндай схемалар зиянды болуы мүмкін бүйірлік бөренелерді қосады)[13]). Сонымен қатар, изотропты ажыратымдылыққа әр түрлі бұрыштарда бір үлгіден алынған 3D кескін стектерін есептеу арқылы біріктіру арқылы қол жеткізуге болады. Содан кейін бір стекте жоқ тереңдіктің ажыратымдылығы туралы ақпарат екінші стектен жеткізіледі; мысалы, екі ортогоналды стектерде бір қабаттағы (нашар ажыратымдылық) осьтік бағыт екінші қабаттағы (жоғары ажыратымдылықты) бүйірлік бағыт болып табылады.
LSFM-нің бүйірлік ажыратымдылығын пайдалану арқылы Abbe шегінен тыс жақсартуға болады супер ажыратымдылықтағы микроскопия техникалар, мысалы. бір фторофорды қолданылған оптикалық жүйенің номиналды ажыратымдылығынан гөрі кеңістіктік дәлдікпен анағұрлым жоғары орналастыруға болатындығын ескере отырып (қараңыз) микроскопиялық локализацияның стохастикалық әдістері ).[22] Сондай-ақ жарықтандырудың құрылымдық әдістері LSFM секцияларының оптикалық қабілетін одан әрі жақсарту үшін қолданылды.[23]
Жолақ артефактілері

Әдетте жарықтандыру үлгіні бір жағынан еніп жатқанда, жарық парағында тұрған кедергілер оның сапасына шашырау және / немесе сіңіру арқылы кедергі келтіруі мүмкін. Әдетте бұл кескіндердегі қараңғы және жарқын жолақтарға әкеледі. Егер сынамалардың бөліктері сыну көрсеткішінен едәуір жоғары болса (мысалы, жасушалардағы липидті көпіршіктер), олар сонымен қатар фокустық әсерге әкелуі мүмкін, нәтижесінде бұл құрылымдардың артында жарқын жолақтар пайда болады. Бұл артефактіні жеңу үшін жарық парақтары мыс. «айналдыру». Бұл дегеніміз, жарық парағының түсу бағыты бірнеше градусқа (~ 10 °) жылдам өзгереді (~ 1 кГц жылдамдығы), сондықтан жарық кедергі аймақтарының артына түседі. Бұл артефактілерді одан әрі азайту үшін жарықтандыруды екі (бұрылған) жарықшақтармен (жоғарыдан қараңыз) жүргізуге болады.[8]Сонымен қатар, VSNR (Variational Stasionary Noise Remover) деп аталатын алгоритм жасалды және ол тегін Фиджи плагині ретінде қол жетімді. [34]
Тарих
20 ғасырдың басында, R. A. Zsigmondy таныстырды ультрамикроскоп қараңғы өрісті микроскопияға жарықтандырудың жаңа схемасы ретінде. Мұнда күн сәулесі немесе ақ шам жарық дәлдігін кесу үшін қолданылады. Содан кейін жарықшақты конденсатор линзасы арқылы үлгіні жарықтандырады. Шашырау (суб-дифрактивті) бөлшектерді микроскоппен перпендикуляр түрде байқауға болады. Бұл қондырғы өлшемдері микроскоптың ажыратымдылығынан кіші бөлшектерді байқауға мүмкіндік берді және 1925 жылы Зсигмондиге Нобель сыйлығын берді.[35]
Флуоресценттік микроскопия үшін осы жарықтандыру сызбасының алғашқы қолданылуы 1993 жылы жарық көрді Voie және басқалар. ортогональды-жазықтықты флуоресценциялы оптикалық кесінді (OPFOS) атымен.[4] ішкі құрылымын бейнелеу үшін коклеа. Ол кездегі ажыратымдылық 10 мкм бойлыққа және 26 мк ұзына бойына шектелген, бірақ миллиметр диапазонындағы үлгінің өлшемінде. OPFOS микроскопы жарықтандыру үшін қарапайым цилиндрлік линзаны қолданды. SPIM-ді одан әрі дамыту және жетілдіру 2004 жылдан басталды.[5] Осы жарияланымнан кейін Хуйскен және басқалар. әдістеме кең қолданыста болды және қазіргі кезде де өлшеудің жаңа жағдайларына бейімделген (жоғарыдан қараңыз). 2010 жылдан бастап флуоресценция қоздырғышымен және шектеулі ажыратымдылығымен алғашқы ультрамикроскоп[36] және 2012 жылдан бастап бірінші SPIM коммерциялық қол жетімді.[37] SPIM-ді дамыту туралы жақсы шолу рефератта келтірілген.[38] 2012 жыл ішінде ашық ақпарат көзі LSFM құрылыстарының толық жоспарларын және қажетті бағдарламалық жасақтаманы еркін жариялайтын жобалар пайда бола бастады.[39][40][41][42]
Қолданбалар
SPIM / LSFM көбінесе даму биологиясында қолданылады, мұнда эмбрионның дамуын ұзақ (бірнеше күн) бақылауға мүмкіндік береді (тіпті ағаштарды толықтай қалпына келтіргенде де).[5][43] SPIM-ді техникамен біріктіруге болады флуоресценттік корреляциялық спектроскопия флуоресцентті бөлшектердің кеңістіктік шешілген қозғалғыштығын өлшеуге мүмкіндік беру (мысалы, флуоресцентті моншақ, кванттық нүктелер немесе флуоресцентті ақуыздар) тірі биологиялық үлгілердің ішіндегі.[19][20]
Ми немесе бүйрек сияқты қатты шашырайтын биологиялық тіндерді SPIM-ге түсірмес бұрын химиялық жолмен бекітіп, тазарту керек.[44] Ол үшін тіндерді тазартудың арнайы әдістері әзірленген, мысалы. 3DISCO, КУБИК және АЙҚЫНДЫҚ. Байланысты сыну көрсеткіші сәйкес тазартылған үлгіден батыру сұйықтықтары және бейнелеу кезінде қалааралық арнайы мақсаттар қолданылуы керек.
H2B-HcRed экспрессиясын білдіретін тірі сфероидты SPIM-бейнелеу. Әр үш минут сайын тілімдер аралығы 1 мкм 100 кесіндіден тұратын Z-стектер тіркелді (10 × объективті, NA = 0,3). Z-стектерінің максималды проекциясы әр уақыт нүктесі үшін көрсетілген.[45]
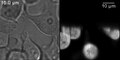
EzDSLM көмегімен алынған DiI-таңбаланған амебалардың еркін қозғалатын суреттері.[46]
HeLa жасушалары тетрамерлерін білдіретін жасыл флуоресцентті ақуыз. Сол жақта трансмиссиялық жарықтандыру кескіні, ал оң жақта LSFM кескіні көрсетілген. Көлеңкелер сияқты типтік SPIM артефактілері айқын көрінеді. Жарық парағы төменнен жоғары бағытталды.
Жоғарыдағы суреттегі z-стектің көлемдік қайта құруы.

Тінтуірдің миы (Thy-1 GFP-M) көмегімен тазартылды 3DISCO әдісі және жарық парағының микроскопиясы арқылы бейнеленген.
Әдебиеттер тізімі
- ^ Фадеро, ТК .; т.б. (2018). «LITE микроскопиясы: модельді ағзалардың көлбеу ақшыл қоздырғышы жоғары ажыратымдылық пен фототазартуды ұсынады». Жасуша биологиясының журналы. 217 (5): 1869–1882. дои:10.1083 / jcb.201710087. PMC 5940309. PMID 29490939.
- ^ Келлер, Филипп Дж.; Stelzer, Ernst H. K. (2006). «Lichtscheiben-Mikroskopie in der molekularen Zellbiophysik» (PDF). Лейборвельт. 7 (5): 18–21.
- ^ Томер, Раджу; Ловетт-Баррон, Мэттью; Каувар, Ысқақ; Андалман, Аарон; Бернс, Ванесса М .; Санкаран, Сетураман; Гросеник, Логан; Брокстон, Майкл; Янг, Самуил; Дейзерот, Карл (2015). «SPED жарық парағының микроскопиясы: биологиялық жүйенің құрылымы мен қызметін жылдам картаға түсіру». Ұяшық. 163 (7): 1796–1806. дои:10.1016 / j.cell.2015.11.061. ISSN 0092-8674. PMC 4775738. PMID 26687363.
- ^ а б A. H. Voie; Бернс Д. Ф.А.Спельман (1993 ж. Маусым). «Ортогональды-жазықтықтағы флуоресценциялы оптикалық кесінді: макроскопиялық биологиялық үлгілерді үш өлшемді бейнелеу». Микроскопия журналы. 170 (3): 229–236. дои:10.1111 / j.1365-2818.1993.tb03346.x. ISSN 0022-2720. PMID 8371260. S2CID 2901024.
- ^ а б c Хискен Дж .; Свогер Дж .; Дель Бене, Ф .; Виттбродт, Дж .; Stelzer, E. H. (2004). «Тікелей эмбриондардың ішіндегі оптикалық кесіндімен жазықтықты жарықтандыруды микроскопиялық әдіспен кесу». Ғылым. 305 (5686): 1007–1009. Бибкод:2004Sci ... 305.1007H. CiteSeerX 10.1.1.456.2250. дои:10.1126 / ғылым.1100035. PMID 15310904. S2CID 3213175.
- ^ Тимо карталары; Норберт Джер; Андреа Чаки; Надин Фоглер; Юрген Попп; Вольфганг Фрицше (2012 ж. 5 қараша). «1912 ж. Иммерсиялық ультрамикроскопияның өнертабысы-нанотехнологияның тууы?». Angewandte Chemie International Edition. 51 (45): 11208–11212. дои:10.1002 / anie.201204688. ISSN 1433-7851. PMID 23065955.
- ^ а б Грегер, К; Свогер, Дж; Stelzer, EH (ақпан 2007). «Флуоресцентті бір жазықтықты жарықтандыру микроскопының негізгі құрылымдық бөліктері және қасиеттері». Ғылыми инструмент. 78 (2): 023705–023705–7. Бибкод:2007RScI ... 78b3705G. дои:10.1063/1.2428277. PMID 17578115.
- ^ а б c Хискен, Ян; Штайнер, Дидье Ю.Р (2007). «Тіпті көп бағытты таңдаулы жазықтық жарықтандыру микроскопиясы арқылы флуоресценцияны қоздыру (mSPIM)». Оптика хаттары. 32 (17): 2608–10. Бибкод:2007 жыл ... 32.2608H. дои:10.1364 / OL.32.002608. ISSN 0146-9592. PMID 17767321. S2CID 15231468.(жазылу қажет)
- ^ Томер, Раджу; Хайри, Халед; Амат, Фернандо; Келлер, Филипп Дж (3 маусым 2012). «Бір мезгілде мультипликациялық мультипликациялық мультипликациямен дамып келе жатқан эмбриондардың сандық жоғары жылдамдығы». Табиғат әдістері. 9 (7): 755–763. дои:10.1038 / nmeth.2062. ISSN 1548-7091. PMID 22660741. S2CID 14191130.(жазылу қажет)
- ^ Крчич, Урос; Гюнтер, Стефан; Сондерс, Тимоти Э; Стрейхан, Себастьян Дж; Хуфнагель, Ларс (3 маусым 2012). «Тото кескінді жылдам түсіруге арналған мультипликативті жарық парақты микроскоп». Табиғат әдістері. 9 (7): 730–733. дои:10.1038 / nmeth.2064. ISSN 1548-7091. PMID 22660739. S2CID 13388657.(жазылу қажет)
- ^ Келлер, П.Ж .; Шмидт, А.Д .; Виттбродт, Дж .; Стельцер, Е.Х.К. (14 қараша 2008). «Зебрафиштің эмбриондық дамуын сканерленген жарық парағының микроскопиясы арқылы қалпына келтіру» (PDF). Ғылым. 322 (5904): 1065–1069. Бибкод:2008Sci ... 322.1065K. дои:10.1126 / ғылым.1162493. ISSN 0036-8075. PMID 18845710. S2CID 7594561.
- ^ Фарбах, Ф. О .; Рорбах, А. (қараша, 2010). «Өздігінен қалпына келетін фазалық пішінді сәулелермен сызылған сканерленген ақ парақты микроскоп». Optics Express. 18 (23): 24229–24244. Бибкод:2010OExpr..1824229F. дои:10.1364 / oe.18.024229. PMID 21164769.
- ^ а б Планчон, Т.А .; Гао, Л .; Милки, Д. Е .; Дэвидсон, М. В .; Гэлбрейт, Дж. А .; Гэлбрейт, Дж .; Бетциг, Э. (2011). «Тірі жасушаларды үш өлшемді жылдам изотропты бейнелеу Бессель сәулесінің жазықтық сәулеленуін қолдану». Табиғат әдістері. 8 (5): 417–423. дои:10.1038 / nmeth.1586. PMC 3626440. PMID 21378978.
- ^ Веттенбург, Том; Дальгарно, Хизер I С; Нилк, Джонатан; Колл-Лладо, Клара; Ферриер, Дэвид Е К; Žižmár, Tomáš; Ганн-Мур, Фрэнк Дж; Долакия, Кишан (2014). «Жеңіл парақты микроскопия» (PDF). Табиғат әдістері. 11 (5): 541–544. дои:10.1038 / nmeth.2922. hdl:10023/5521. PMID 24705473. S2CID 205422713.
- ^ Нилк, Джонатан; Макклуски, Калей; Прекиадо, Мигель А .; Мазилу, Майкл; Ян, Чжэньи; Ганн-Мур, Фрэнк Дж .; Аггарвал, Саня; Телло, Хавьер А .; Ferrier, David E. K. (1 сәуір 2018). «Жеңілістен компенсацияланған көбейту-инвариантты сәулелермен жарық парақты микроскопия». Ғылым жетістіктері. 4 (4): eaar4817. arXiv:1708.02612. Бибкод:2018SciA .... 4.4817N. дои:10.1126 / sciadv.aar4817. PMC 5938225. PMID 29740614.
- ^ Dunsby, C. (2008). «Қиғаш жазықтықтағы микроскопия арқылы оптикалық кесіндімен кескіндеме». Optics Express. 16 (25): 20306–16. Бибкод:2008OExpr..1620306D. дои:10.1364 / OE.16.020306. hdl:10044/1/53595. ISSN 1094-4087. PMID 19065169.
- ^ Зено Лавагнино; Франческа Селла Заначки; Эмилиано Ронзитти; Альберто Диаспро (2013). «Екі-фотонды қоздырғыштың жоғары шашыранды үлгілердің жазықтық жарықтандырғыш таңдамалы микроскопиясы (2PE-SPIM): сипаттамасы және қолданылуы». Optics Express. 21 (5): 5998–6008. Бибкод:2013OExpr..21.5998L. дои:10.1364 / OE.21.005998. ISSN 1094-4087. PMID 23482168.
- ^ Қасқыр S, Supatto W, Debregeas G, Mahou P, Kruglik SG, Sintes J, Beaurepaire E, Candelier R (мамыр 2015). «Екі фотонды жарық парағының микроскопиясымен бүкіл мидың функционалды бейнесі». Хат алмасу. Табиғат әдістері. 12 (5): 379–80. дои:10.1038 / nmeth.3371. PMID 25924070. S2CID 19746295.
- ^ а б c г. Капулад Дж .; Вахсмут, М .; Хуфнагель, Л .; Кноп, М. (2011). «Белоктың диффузиясының сандық флуоресценттік бейнесі және тірі жасушалардағы өзара әрекеттесу». Табиғи биотехнология. 29 (9): 835–839. дои:10.1038 / nbt.1928. PMID 21822256. S2CID 10493584.
- ^ а б c Волланд, Т .; Ши, Х .; Санкаран, Дж .; Stelzer, E. H. (мамыр 2010). «Біртекті емес үш өлшемді орталардың жарықтандырғыш флуоресцентті корреляциялық спектроскопиясы (SPIM-FCS) зондтары». Optics Express. 18 (10): 10627–10641. Бибкод:2010OExpr..1810627W. дои:10.1364 / oe.18.010627. PMID 20588915.
- ^ Клаус Грегер; Мануэл Дж. Нетц; Рейно Эммануэль; Эрнст Х.К. Stelzer (2011). «Бір өлшемді флюоресценттік өмірді бір жазықтықта жарық беретін микроскоппен бейнелеу шудың арақатынасына жақсартылған сигнал береді». Optics Express. 19 (21): 20743–50. Бибкод:2011OExpr..1920743G. дои:10.1364 / OE.19.020743. ISSN 1094-4087. PMID 21997084.
- ^ а б Франческа Селла Заначки; Зено Лавагнино; Мишела Перроне Доннорсо; Alessio Del Bue; Лаура Фуриа; Марио Фаретта; Альберто Диаспро (9 қазан 2011). «Қалың биологиялық үлгілердегі тірі жасушалы 3D супер ажыратымдылықтағы бейнелеу». Табиғат әдістері. 8 (12): 1047–1049. дои:10.1038 / nmeth.1744. ISSN 1548-7091. PMID 21983925. S2CID 205420075.
- ^ а б Джером Мерц; Джинхён Ким (2010). «HiLo фонынан бас тарту арқылы бүкіл тышқанның миында ақшыл парақты микроскопияны сканерлеу». Биомедициналық оптика журналы. 15 (1): 016027–016027–7. Бибкод:2010JBO .... 15a6027M. дои:10.1117/1.3324890. ISSN 1083-3668. PMC 2917465. PMID 20210471.
- ^ Фридрих, Майк; Ган, Цян; Ермолаев, Владимир; Harms, Григорий С. (2011). «STED-SPIM: Эмиссиялық ынталандыру сарқылуы парақтың жарықтандырылуының микроскопиялық шешімін жақсартады». Биофизикалық журнал. 100 (8): L43-5. Бибкод:2011BpJ ... 100L..43F. дои:10.1016 / j.bpj.2010.12.3748. PMC 3077687. PMID 21504720..
- ^ Fadero TC және т.б. 2017. «LITE микроскопиясы: жоғары сандық апертура, флуоресценттік фотосурет түсірудің төмен әдістемесі» bioRxiv doi: https://doi.org/10.1101/181644 https://www.biorxiv.org/content/early/2017/10/04/181644.1
- ^ Джоранд Р және т.б. 2012. «Қалың біртекті емес үлгілерді терең және айқын оптикалық бейнелеу» PLOS one doi:https://doi.org/10.1371/journal.pone.0035795
- ^ Jorand R, 2013. «SPIM pour l'imagerie 3D des sphéroïdes микроскопының декорациясы және сәулеленуінің амелиорациясы» theses.fr https://www.theses.fr/180545140
- ^ Алексис Майзель, Даниэл фон Вангенхайм, Ферн н Федериси, Джим Хаселофф, Эрнст Х.К. Stelzer (қазан 2011). «Флуоресцентті жарық парағының микроскопиясын қолдана отырып, физиологиялық жарық жағдайында өсімдіктердің өсуін жоғары ажыратымдылықта тірі бейнелеу». Зауыт журналы. 68 (2): 377–385. дои:10.1111 / j.1365-313X.2011.04692.x. ISSN 0960-7412. PMID 21711399.CS1 maint: бірнеше есімдер: авторлар тізімі (сілтеме)
- ^ Терренс Ф. Холекамп; Диуакар Турага; Тимоти Э. Қасиетті (13 наурыз 2008). «Нейрондық популяциялардағы белсенділікті үш өлшемді флуоресценттік бейнелеу объективті-жалпақ жазықтық жарықтандыру микроскопиясы арқылы». Нейрон. 57 (5): 661–672. дои:10.1016 / j.neuron.2008.01.011. ISSN 0896-6273. PMID 18341987. S2CID 9571663.
- ^ Ю.Ву; А.Гитани; Р.Кристенсен; А.Сантелла; З. Ду; Г.Рондо; З.Бао; Д. Колон-Рамос; Х.Шрофф (2011 ж., 25 қазан). «Іріктелген жазықтықты жарықтандыратын микроскопия (iSPIM)» канорабдит элегандарындағы жасуша идентификациясы мен нейро-дамуды бейнелеуге мүмкіндік береді «. Ұлттық ғылым академиясының материалдары. 108 (43): 17708–17713. Бибкод:2011PNAS..10817708W. дои:10.1073 / pnas.1108494108. ISSN 0027-8424. PMC 3203761. PMID 22006307.
- ^ а б c Ву, Йиконг; Ваврзусин, Петр; Сенсеней, Джастин; Фишер, Роберт С; Кристенсен, Райан; Сантелла, Энтони; Йорк, Эндрю Дж; Қыс, Питер В; Уотерман, Клар М; Бао, Жиронг; Колон-Рамос, Даниэль А; Маколифф, Мэттью; Шроф, Хари (2013). «Екі жақты көрінетін жазықтық жарықтандыру микроскопиясымен кеңістіктік изотропты төртөлшемді бейнелеу». Табиғи биотехнология. 31 (11): 1032–1038. дои:10.1038 / nbt.2713. ISSN 1087-0156. PMC 4105320. PMID 24108093.
- ^ «Huisken зертханасы». Архивтелген түпнұсқа 2014 жылғы 7 шілдеде.
- ^ Йорг Риттер; Роман Вейт; Ян-Питер Зибрас; Ульрих Крибичек (2008), «Фокустық жазықтықты селективті микроскопия әдісімен контрастты бір бөлшекті бақылау», Optics Express, 16 (10), 7142-52 бб, Бибкод:2008OExpr..16.7142R, дои:10.1364 / OE.16.007142, ISSN 1094-4087, PMID 18545417
- ^ Джером Ференбах; Пьер Вайс; Корин Лоренцо (2012). «Стационарлық шуды жоюдың вариациялық алгоритмдері: бейнелеудің микроскопияға қосымшалары» (PDF). IEEE кескінді өңдеу бойынша транзакциялар. 21 (10): 4420–4430. Бибкод:2012ITIP ... 21.4420F. дои:10.1109 / TIP.2012.2206037. ISSN 1057-7149. PMID 22752131. S2CID 6828193.
- ^ Р. Зсигмондидің Нобель дәрісі: Коллоидтардың қасиеттері (ультрамикроскоптың қысқаша түсініктемесін қоса)
- ^ LaVision Biotech пресс-релизі Мұрағатталды 24 желтоқсан 2013 ж Wayback Machine (қол жеткізілген 2012-11-04)
- ^ Lightsheet Z.1 Light Sheet микроскоп жүйесі туралы Carl Zeiss пресс-релизі (қол жеткізілген 2012-11-15)
- ^ P. A. Santi (1 ақпан 2011). «Жеңіл парақтың флуоресценттік микроскопиясы: шолу». Гистохимия және цитохимия журналы. 59 (2): 129–138. дои:10.1369/0022155410394857. ISSN 0022-1554. PMC 3201139. PMID 21339178.
- ^ OpenSPIM жобасының веб-парағы (қол жеткізілген 2013-06-08)
- ^ Питер Дж Питроне; Йоханнес Шинделин; Люк Стювенберг; Стефан Прейбиш; Майкл Вебер; Кевин В Элисейри; Ян Хискен; Павел Томанкак (9 маусым 2013). «OpenSPIM: ашық парақты микроскопия платформасы». Табиғат әдістері. 10 (7): 598–9. arXiv:1302.1987. дои:10.1038 / nmeth.2507. ISSN 1548-7091. PMC 7450513. PMID 23749304.
- ^ OpenSPIN жобасының веб-парағы (қол жеткізілген 2013-06-08)
- ^ Эмилио Дж Гуалда, Тиаго Вале, Педро Альмада, Джос А Фейдж, Габриэль Мартинс, Нуно Морено (9 маусым 2013). «OpenSpinMicroscopy: ашық көзді интеграцияланған микроскопия платформасы». Табиғат әдістері. 10 (7): 599–600. дои:10.1038 / nmeth.2508. ISSN 1548-7091. PMID 23749300. S2CID 27935584.CS1 maint: бірнеше есімдер: авторлар тізімі (сілтеме)
- ^ Вервир, П.Ж .; Свогер Дж .; Пампалони, Ф .; Грегер, К .; Марчелло, М .; Stelzer, E. H. (2007). «Жеңіл параққа негізделген микроскопиямен үлкен үлгілерді жоғары ажыратымдылықты үш өлшемді бейнелеу». Табиғат әдістері. 4 (4): 311–313. дои:10.1038 / nmeth1017. PMID 17339847. S2CID 12440781.
- ^ Джерлинг, Нина; Беккер, Клаус; Вегенаст-Браун, Беттина М .; Grathwohl, Стефан А .; Джакер, Матиас; Додт, Ханс-Ульрих (27 мамыр 2015). Виторика, Хавьер (ред.) «Ультрамикроскопия әдісімен зерттелген тышқандардағы ми-амилоидоз». PLOS ONE. 10 (5): e0125418. Бибкод:2015PLoSO..1025418J. дои:10.1371 / journal.pone.0125418. ISSN 1932-6203. PMC 4446269. PMID 26017149.
- ^ Корин Лоренцо; Селин Фронгия; Рафаэль Джоранд; Джером Ференбах; Пьер Вайс; Амина Мандхуй; Гийом Гей; Бернард Дюкомун; Валери Лобжуа (2011). «Жеңіл парақты микроскопияны қолдана отырып, 3D сфероидты ісік модельдеріндегі жасушалардың бөліну динамикасын бақылау». Ұяшық бөлімі. 6 (1): 22. дои:10.1186/1747-1028-6-22. ISSN 1747-1028. PMC 3274476. PMID 22152157.
- ^ Дайсуке Такао; Атсуши Танигучи; Такааки Такеда; Сейджи Сонобе; Шигенори Нонака; Александр Дж. Кабла (2012 ж. 5 желтоқсан), «Жарық парағының микроскопиясын қолданып, амебоидтық қозғалыстарды жылдам бейнелеу», PLOS ONE, 7 (12), б. e50846, Бибкод:2012PLoSO ... 750846T, дои:10.1371 / journal.pone.0050846, ISSN 1932-6203, PMC 3515486, PMID 23227214
Әрі қарай оқу
- Шолу: P. A. Santi (1 ақпан 2011). «Жеңіл парақтың флуоресценттік микроскопиясы: шолу». Гистохимия және цитохимия журналы. 59 (2): 129–138. дои:10.1369/0022155410394857. ISSN 0022-1554. PMC 3201139. PMID 21339178.
- Әр түрлі LSFM модульдері мен даму биологиясының нәтижелерін шолу: Хискен Дж .; Штайнер, Д.Р. (22 мамыр 2009). «Даму биологиясындағы жазықтықты микроскопиямен таңдап жарықтандыру әдістері». Даму. 136 (12): 1963–1975. дои:10.1242 / dev.022426. ISSN 0950-1991. PMC 2685720. PMID 19465594.
- Анатомиялық құрылымдарды бейнелеу үшін LSFM шолуы: Буйтаерт, Дж .; Декамптар, Эмили; Адриенс, Доминик; Dirckx, Joris J. J. (12 тамыз 2011). «OPFOS микроскопиялық отбасы: биомедициналық үлгілерді жоғары ажыратымдылықпен оптикалық бөлу». Халықаралық анатомия. 2012: 206238–(1–9). arXiv:1106.3162. Бибкод:2011arXiv1106.3162B. дои:10.1155/2012/206238. PMC 3335623. PMID 22567307.
- Редакциялық: «Жыл әдісі 2014». Табиғат әдістері. 12 (1): 1. 30 желтоқсан 2014 ж. дои:10.1038 / nmeth.3251. PMID 25699311.

Сыртқы сілтемелер
- SPIM-ді қолдана отырып, даму биологиясындағы типтік эксперимент туралы бейне қосулы YouTube: Байланыстырылған бейнеде 20 сағат ішінде тіркелген жемісті шыбын эмбрионның дамуын көрсетеді. Толық 3D жиынтығының екі проекциясы көрсетілген.
- MesoSPIM бастамасы. Тазартылған тіндерді кескіндеуге арналған ашық көзді жеңіл парақты микроскоптар.