Изотермиялық процесс - Isothermal process - Wikipedia
| Термодинамика | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Классикалық Карно жылу қозғалтқышы | ||||||||||||
| ||||||||||||
| ||||||||||||
Жылы термодинамика, an изотермиялық процесс түрі болып табылады термодинамикалық процесс онда температура туралы жүйе тұрақты болып қалады: ΔТ = 0. Бұл, әдетте, жүйе сыртпен байланыста болған кезде пайда болады жылу қоймасы және жүйенің өзгеруі жүйенің резервуардың температурасына сәйкес келуін жалғастыру үшін жеткілікті баяу жүреді жылу айырбастау (қараңыз квази тепе-теңдік ). Керісінше, адиабаталық процесс бұл жерде жүйе жоқ санымен алмасады жылу онымен орта (Q = 0).
Жай деп айтуға болады изотермиялық процесс
- Үшін идеалды газдар тек, ішкі энергия
кезінде адиабаталық процестер:
Мысалдар
Изотермиялық процестер температураны реттеудің кейбір құралдары бар, соның ішінде жоғары құрылымды жүйенің кез келген түрінде болуы мүмкін машиналар, тіпті өмір сүру жасушалар. Кейбіреулерінің циклдерінің кейбір бөліктері жылу қозғалтқыштары изотермиялық түрде жүзеге асырылады (мысалы, Карно циклі ).[1] Термодинамикалық анализінде химиялық реакциялар, алдымен изотермиялық жағдайда не болатынын талдап, содан кейін температураның әсерін қарастыру әдеттегідей.[2] Фазалық өзгерістер, сияқты балқу немесе булану, сонымен қатар, олар әдеттегідей тұрақты қысым кезінде пайда болатын изотермиялық процестер болып табылады.[3] Изотермиялық процестер жиі қолданылады және күрделі, изотермиялық емес процестерді талдаудың бастапқы нүктесі.
Изотермиялық процестер идеал газдар үшін ерекше қызығушылық тудырады. Бұл салдары Джоульдің екінші заңы онда ішкі энергия идеал газдың бекітілген мөлшерінің тек оның температурасына тәуелді.[4] Сонымен, изотермиялық процесте идеал газдың ішкі энергиясы тұрақты болады. Бұл идеал газда болмайтындығының нәтижесі молекулааралық күштер.[4] Бұл тек идеалды газдарға қатысты екенін ескеріңіз; ішкі энергия қысымға, сондай-ақ сұйықтықтарға, қатты денелерге және нақты газдарға арналған температураға байланысты.[5]
Газдың изотермиялық сығылуында жүйеде көлемді азайту және қысымды жоғарылату бойынша жұмыс жасалады.[4] Газға жұмыс жасау ішкі энергияны арттырады және температураны жоғарылатуға бейім болады. Температураны тұрақты ұстап тұру үшін жүйені жылу ретінде қалдырып, қоршаған ортаға ену керек. Егер газ идеал болса, қоршаған ортаға түсетін энергия мөлшері газда жасалған жұмысқа тең, өйткені ішкі энергия өзгермейді. Изотермиялық кеңею үшін жүйеге берілген энергия қоршаған ортада жұмыс істейді. Кез-келген жағдайда, тиісті байланыстың көмегімен газ көлемінің өзгеруі пайдалы механикалық жұмыстарды орындай алады. Есептеулер туралы толығырақ ақпаратты қараңыз жұмысты есептеу.
Үшін адиабаталық процесс, онда оның ішіне ыдыс жақсы оқшауланғандықтан ешқандай жылу газға түспейді немесе сыртқа шықпайды Q = 0. Егер де орындалған жұмыс болмаса, яғни а еркін кеңейту, ішкі энергияда өзгеріс болмайды. Идеал газ үшін бұл процесс изотермиялық болатындығын білдіреді.[4] Осылайша, процестің изотермиялық екенін көрсету ерекше процесті көрсету үшін жеткіліксіз.
Идеал газ туралы мәліметтер

Газдың ерекше жағдайы үшін Бойль заңы[4] қолданылады, өнім pV егер газ изотермиялық жағдайда сақталса, тұрақты болып табылады. Тұрақтының мәні nRT, қайда n бұл газдың моль саны және R болып табылады идеалды газ тұрақтысы. Басқаша айтқанда идеалды газ заңы pV = nRT қолданылады.[4] Сондықтан:
ұстайды. Осы теңдеу нәтижесінде пайда болатын қисықтар отбасы 1-суреттегі графикте көрсетілген. Әрбір қисық изотерма деп аталады. Мұндай графиктер деп аталады индикаторлық диаграммалар және бірінші қолданған Джеймс Уотт және басқалары қозғалтқыштардың тиімділігін бақылауға арналған. Суреттегі әрбір қисыққа сәйкес келетін температура төменгі солдан жоғарғы оңға қарай жоғарылайды. Журнал (p¹v1)
Жұмысты есептеу
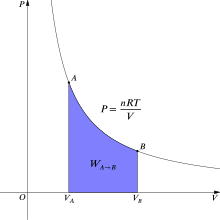
Термодинамикада газ күйден өзгерген кезде жүретін қайтымды жұмыс A мемлекетке B болып табылады[6]
Изотермиялық үшін қайтымды процесс, бұл интеграл тиісті қысым көлемінің изотермасы астындағы ауданға тең және идеал газ үшін күлгін түспен 2-суретте көрсетілген. Тағы да, б = nRT/V қолданылады және Т тұрақты болып табылады (бұл изотермиялық процесс болғандықтан) жұмыс өрнегі келесідей болады:
Әдетте, жұмыс қоршаған ортаға байланысты жүйедегі жұмыс ретінде анықталады. Егер, мысалы, жүйе сығылған болса, онда жұмыс оң болады және жүйенің ішкі энергиясы артады. Керісінше, егер жүйе кеңейсе, ол қоршаған ортада жұмыс істейді және жүйенің ішкі энергиясы төмендейді.
Сондай-ақ, идеал газдар үшін температура тұрақты болса, жүйенің ішкі энергиясы да тұрақты болатындығын ескеру керек, сондықтан ΔU = 0. бастап Термодинамиканың бірінші заңы that екенін айтадыU = Q + W (IUPAC конвенция), содан шығады Q = −W изотермиялық қысу немесе идеал газдардың кеңеюі үшін.
Изотермиялық процестің мысалы
Анның қайтымды кеңеюі идеалды газ изотермиялық процесте өндірілген жұмыс мысалы ретінде пайдалануға болады. Жылудың пайдалы жұмысқа айналу дәрежесі және шектеу арасындағы байланыс ерекше қызығушылық тудырады күш және кеңею дәрежесі.
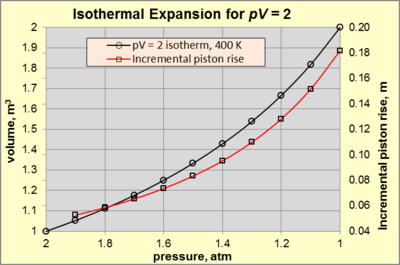
Изотермиялық кеңею кезінде, екеуі де б және V тұрақтымен изотерма бойымен өзгеру pV өнім. Биіктігі 1 м және 1 м цилиндрлік камерада жұмыс істейтін газды қарастырайық2 ауданы 400 К д статикалық тепе-теңдік. The орта 300 К және 1 атм қысымдағы ауадан тұрады (ретінде белгіленеді) бsurr). Жұмыс газы механикалық құрылғыға қосылған поршеньмен шектеледі, ол 2 атм қысымды құруға жеткілікті күш көрсетеді (күй A). Күйдің кез-келген өзгерісі үшін A күштің төмендеуін тудыратын болса, газ кеңейіп, айналада жұмыс жасайды. Изотермиялық кеңею қолданылатын күш азайып, тиісті жылу қосылса ғана жалғасады pV = 2. Егер поршень қозғалысы әр сәтте газдың температурасы мен қысымы бірқалыпты және сәйкес келсе, баяу болса, кеңею қайтымды болады. идеалды газ заңы. 3-суретте б–V үшін қатынас pV = 2 атмосферадан изотермиялық кеңею үшін (күй) A) 1 атмға дейін (күй B).
Атқарылған жұмыс (тағайындалған) ) екі компоненттен тұрады. Біріншіден, кеңейту қоршаған атмосфералық қысымға қарсы жұмыс (ретінде белгіленген) WбΔV), екіншіден, пайдалануға жарамды механикалық жұмыс (ретінде белгіленді Wмех). Шығу Wмех мұнда иінді білікті айналдыру үшін қолданылатын поршеннің қозғалысы болуы мүмкін, содан кейін суды көтеруге қабілетті шкив айналады су басқан тұз шахталары.
Жүйе күйге жетеді B (б = 1 атм және V = 2 м3) қолданылатын күш нөлге жеткенде. Сол кезде, тең - 140,5 кДж, және WбΔV –101,3 кДж құрайды. Айырмашылық бойынша, Wмех = –39,1 кДж, бұл процеске берілген жылудың 27,9% құрайды. Бұл мәлімделген шарттарда процестен алынатын пайдаланылатын механикалық жұмыстың максималды мөлшері. Пайыз Wмех функциясы болып табылады pV және бsurr, және 100% -ке жақындайды бsurr нөлге жақындайды.
Изотермиялық кеңею сипатын одан әрі жалғастыру үшін 3-суреттегі қызыл сызықты ескеріңіз pV поршень көтерілуінің экспоненциалды өсуін және қысымның төмендеуін тудырады. Мысалы, қысымның 2-ден 1,9 атм-ға дейін төмендеуі поршеннің 0,0526 м көтерілуіне әкеледі. Салыстырмалы түрде, қысымның 1,1-ден 1 атм-ға дейін төмендеуі поршеньнің 0,1818 м-ге көтерілуіне әкеледі.
Энтропия өзгереді
Изотермиялық процестер әсіресе өзгерістерді есептеу үшін ыңғайлы энтропия өйткені, бұл жағдайда энтропияның формуласы өзгереді, ΔS, жай
қайда Qайн - бұл жүйеге қайтымды түрде берілетін жылу және Т болып табылады абсолюттік температура.[7] Бұл формула гипотетикалық үшін ғана жарамды қайтымды процесс; яғни тепе-теңдік барлық уақытта сақталатын процесс.
Қарапайым мысал - тепе-теңдік фазалық ауысу (мысалы, балқу немесе булану) тұрақты температура мен қысым кезінде жүреді. Тұрақты қысым кезіндегі фазалық ауысу үшін жүйеге берілген жылу тең трансформация энтальпиясы, ΔHтр, осылайша Q = ΔHтр.[3] Кез-келген қысым кезінде ауысу температурасы болады, Ттр, ол үшін екі фаза тепе-теңдікте болады (мысалы, қалыпты) қайнау температурасы сұйықтықтың бір атмосфералық қысыммен булануы үшін). Егер ауысу осындай тепе-теңдік жағдайында жүрсе, онда энтропияның өзгеруін тікелей есептеу үшін жоғарыдағы формула қолданылуы мүмкін[7]
- .
Тағы бір мысал - қалпына келтірілетін изотермиялық кеңею (немесе қысу) идеалды газ бастапқы томнан VA және қысым PA соңғы томға дейін VB және қысым PB. Көрсетілгендей Жұмысты есептеу, газға берілген жылу
- .
Бұл нәтиже қайтымды процеске арналған, сондықтан оны алу үшін энтропияның өзгеру формуласында ауыстыруға болады[7]
- .
Идеал газ бағынатындықтан Бойль заңы, мұны, егер қаласаңыз, қалай болса солай жазуға болады
- .
Алынғаннан кейін, бұл формулаларды an-ге қолдануға болады қайтымсыз процесс сияқты еркін кеңейту идеалды газ. Мұндай кеңею изотермиялық сипатқа ие және қайтымды кеңеюдегідей бастапқы және соңғы күйлерге ие болуы мүмкін. Энтропия - а мемлекеттік функция, жүйенің энтропиясының өзгеруі қайтымды процестегідей және жоғарыдағы формулалармен берілген. Нәтиже екенін ескеріңіз Q Еркін кеңею үшін = 0 энтропияның өзгеру формуласында қолданыла алмайды, өйткені процесс қайтымды болмайды.
Қайтымды және бос кеңеюдің айырмашылығы қоршаған ортаның энтропиясында кездеседі. Екі жағдайда да қоршаған орта тұрақты температурада, Т, сондықтан ΔSсур = −Q/Т; минус таңбасы қолданылады, өйткені қоршаған ортаға берілген жылу шамасы бойынша тең және жылу таңбасына қарама-қарсы, Q, жүйеге ауыстырылды. Қайтымды жағдайда қоршаған ортадағы энтропияның өзгеруі жүйенің өзгеруіне тең және қарама-қарсы, сондықтан Әлемнің энтропиясының өзгерісі нөлге тең. Еркін кеңеюде Q = 0, сондықтан қоршаған ортаның энтропиясы өзгермейді және ғаламның энтропиясының өзгерісі жүйе үшін ΔS тең.
Этимология
«Изотермиялық» сын есімі Грек «тең» дегенді білдіретін «ἴσος» («isos») және «жылу» дегенді білдіретін «θέρμη» («терме»).
Сондай-ақ қараңыз
- Джоуль-Томсон әсері
- Джоульдің кеңеюі (еркін кеңейту деп те аталады)
- Адиабатикалық процесс
- Циклдік процесс
- Изобариялық процесс
- Изохоралық процесс
- Политропты процесс
- Өздігінен жүретін процесс
Әдебиеттер тізімі
- ^ Keenan, J. H. (1970). «12 тарау: Жылу қозғалтқыштарының циклдары». Термодинамика. Кембридж, Массачусетс: MIT Press.
- ^ Rock, P. A. (1983). «11 тарау: Химиялық реакциялардың термодинамикасы». Химиялық термодинамика. Милл Вэлли, Калифорния: Университеттің ғылыми кітаптары. ISBN 0-935702-12-1.
- ^ а б Петруччи, Р.Х .; Харвуд, В.С .; Херринг, Ф. Г .; Мадура, Дж. Д. (2007). «12 тарау». Жалпы химия. Жоғарғы седла өзені, Нджж.: Пирсон. ISBN 978-0-13-149330-8.
- ^ а б c г. e f Клотц, И.М .; Розенберг, Р.М. (1991). «6-тарау, газдардың бірінші заңын қолдану». Химиялық термодинамика. Meno Park, Калифорния: Бенджамин.[ISBN жоқ ]
- ^ Адкинс, Дж. (1983). Тепе-теңдік термодинамика. Кембридж: Кембридж университетінің баспасы.[ISBN жоқ ]
- ^ Аткинс, Питер (1997). «2 тарау: бірінші заң: ұғымдар». Физикалық химия (6-шы басылым). Нью-Йорк, Нью-Йорк: W. H. Freeman and Co. ISBN 0-7167-2871-0.
- ^ а б c Аткинс, Питер (1997). «4 тарау: екінші заң: ұғымдар». Физикалық химия (6-шы басылым). Нью-Йорк, Нью-Йорк: W. H. Freeman and Co. ISBN 0-7167-2871-0.






























