Zaurategrast - Zaurategrast
 | |
| Клиникалық мәліметтер | |
|---|---|
| Басқа атаулар | CDP323 |
| Құқықтық мәртебе | |
| Құқықтық мәртебе |
|
| Идентификаторлар | |
| |
| CAS нөмірі | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| CompTox бақылау тақтасы (EPA) | |
| ECHA ақпарат картасы | 100.158.922 |
| Химиялық және физикалық мәліметтер | |
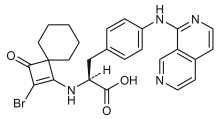
| Формула | C26H25BrN4O3 |
| Молярлық масса | 521.415 г · моль−1 |
| 3D моделі (JSmol ) | |
| |
| |
Zaurategrast (CDP323) шағын молекула есірткі антагонист туралы қан тамырлары жасушаларының адгезия молекуласы 1 (VCAM-1) байланыстыру α4-интегралдар. Ол бастапқыда Британдықтар биофармацевтикалық компания Celltech plc. (қазір UCB S.A. ) және болды болжамды үшін жаңа препарат ауызша емдеу склероз.[1]
2006 жылдың қазанында UCB және Биоген Идец емдеу үшін Зауратрафрастты бірлесіп әзірлеу және коммерцияландыру бойынша ынтымақтастық туралы жариялады склероз және басқа әлеует көрсеткіштер.[2] 2009 жылы маусымда II фазаның көңіл көншітпейтін нәтижелеріне байланысты Зауратрастрды дамыту тоқтатылды клиникалық сынақ.[3]
Қимыл механизмі
The Қимыл механизмі Зауратрастрдың алдын-алуға сенеді деп сенген иммундық жасушалар көшу қан тамырлары ыдыстың қабырғалары арқылы әртүрлі қабынған тіндер, оның ішінде ми. Бұл механизм иммундық жасушалардың бақыланбайтын көші-қоны кезінде байқалатын иммундық реакциялардың жоғарылауын және тіндердің одан әрі зақымдалуын болдырмайды деп ойлайды. Zaurategrast-та бірдей әрекет ету механизмі бар моноклоналды антидене натализумаб.
Жануарлар модельдеріндегі нәтижелер
Зауратрастрас созылмалы түрде зерттелді эксперименттік аутоиммунды энцефаломиелит (EAE) in тышқандар. Препарат берілген кезде тиімді болды профилактикалық (яғни, дейін ауру тышқандарға индукцияланған) және берілген кезде терапиялық (яғни, ауру басталғаннан кейін) және аурудың ауырлығын едәуір төмендеткен.[4]
Клиникалық дамуы
Қауіпсіздік, төзімділік, және фармакокинетикалық Зауреграфтың профилі үш жеке 1-фазалық зерттеулерде 75 ерлер мен сау еріктілерде бағаланды. Күнделікті екі рет 7 рет қабылдаған 1000 мг-ға дейінгі пероральді дозаларда Зауратрастрға жақсы төзімді болды қатарынан күндері жағымсыз жағдай профилімен салыстыруға болады плацебо. Гендерлік әсер болған жоқ. Ауызша қабылдау нәтижесінде пайда болды тежеу VCAM-1 байланысы, оны 12 toler немесе 24 ‑ сағаттық дозада жақсы төзімді дозаларда сақтауға болады[5]
2 кезеңді зерттеу 2007 жылы маусымда басталды Еуропа және АҚШ. Зерттеу антисептикамен емделуден сәтсіздікке ұшыраған, қайталанатын МС-мен ауыратын 200-ден астам пациентті қамтуды көздейді интерферон-бета және алты ай ішінде екі дозаны плацебоға салыстырады. Нәтижелер 2008 жылдың аяғында күтіледі.,[6][7] Аралық тиімділіктің алдын-ала талдауы көрсеткендей, осы клиникалық сынаққа тіркелген пациенттер алты айлық емдеу кезеңінен кейін плацебомен салыстырғанда Зауреграстрадан күткендей пайда ала алмады. Прогрессивті мультифокальды лейкоэнцефалопатия жағдайлары байқалмады.[3]
Әдебиеттер тізімі
- ^ Дэвенпорт RJ, жексенбі JR (шілде 2007). «Альфа4-интегрин антагонизмі - қабыну ауруларын емдеудің тиімді тәсілі?». Бүгінде есірткіні табу. 12 (13–14): 569–76. дои:10.1016 / j.drudis.2007.05.001. PMID 17631252.
- ^ UCB S.A пресс-релизі 2-қазан-2006; 11 қыркүйек-2007 қол жеткізді
- ^ а б UCB: CDP323 қатысты зерттеулерді тоқтату.
- ^ Уотт Г, Гауден V, Макнейл К және басқалар. Шағын молекула VLA-4 антагонисті CDP323-тің C57Bl / 6 тышқандарындағы созылмалы тәжірибелік аллергиялық энцефаломиелитке әсері. ECTRIMS 2005; 11 қыркүйек-2007 қол жеткізді
- ^ Бейкер М, Шок А, Партон Т және басқалар. VLA-4 ингибиторының CDP323 фармакокинетикалық және фармакодинамикалық қасиеттері. ECTRIMS 2006; 11 қыркүйек-2007 қол жеткізді
- ^ UCB S.A пресс-релизі 26-маусым-2007; 11 қыркүйек-2007 қол жеткізді
- ^ Clinicaltrial.gov жазбасы; 11 қыркүйек-2007 қол жеткізді
