Физорбция - Physisorption - Wikipedia
Физорбция, деп те аталады физикалық адсорбция, бұл атомның немесе молекуланың электронды құрылымы әрең қозғалатын процесс адсорбция.[1][2][3]
Кіріспе
Физорбцияның негізгі әсерлесуші күші Ван-дер-Ваальс (VDW) болып табылады. Өзара әрекеттесу энергиясы өте әлсіз болса да (~ 10-100 меВ), табиғатта физорбция маңызды рөл атқарады. Мысалы, ван-дер-Ваальстің беттері мен аяқтарының түктері арасындағы тартылысы геккондар тік қабырғаларға көтерілудің керемет қабілетін қамтамасыз етеді.[4] Ван-дер-Ваальс күштері индукцияланған, тұрақты немесе өтпелі электр дипольдерінің өзара әрекеттесуінен пайда болады.
-Мен салыстырғанда химосорбция, онда байланысатын атомдардың немесе молекулалардың электронды құрылымы өзгертіліп, ковалентті немесе иондық байланыстар түзілетін болса, физорбция химиялық байланыс құрылымының өзгеруіне әкелмейді. Іс жүзінде белгілі бір адсорбцияны физорбция немесе хемисорбция деп жіктеу негізінен тәуелді байланыс энергиясы Физорбция атомдық негізде химиялық байланыспен байланысқан кез-келген байланыс түріне қарағанда әлдеқайда әлсіз болғандықтан, субстратқа адсорбаттың
Сурет заряды бойынша модельдеу
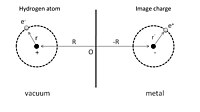
Физорбцияның қарапайым иллюстрациясын беру үшін алдымен суретте көрсетілгендей адсорбцияланған сутегі атомын мінсіз өткізгіштің алдында қарастыруға болады. 1-суретте көрсетілгендей, оң заряды бар ядро орналасқан. R = (0, 0, З) және оның электронының орналасу координаты, р = (х, ж, з) ядроға қатысты беріледі. Адсорбция процесін осы сутегі атомы мен оның өткізгіштегі ядро мен электронның кескіндік зарядтарының өзара әрекеттесуі ретінде қарастыруға болады. Нәтижесінде жалпы электростатикалық энергия тартылыс және итеру мүшелерінің қосындысы болып табылады:
Бірінші мүше - ядро мен оның кескін зарядының тартымды әрекеттестігі, ал екінші мүше - электрон мен оның сурет зарядының өзара әрекеттесуі. Репульсивті өзара әрекеттесу ядро мен кескін электронының өзара әрекеттесуінен туындайтын үшінші және төртінші мүшелерде, сәйкесінше электрон мен кескін ядросының өзара әрекеттесуінде көрсетілген.
Авторы Тейлордың кеңеюі | өкілеттіктеріндер| / |R|, бұл өзара әрекеттесу энергиясын келесі түрде көрсетуге болады:
Жойылмайтын алғашқы терминнен физорбция потенциалы қашықтыққа тәуелді екенін анықтауға болады З адсорбцияланған атом мен беттің арасында З−3, айырмашылығы р−6 молекуланың тәуелділігі ван дер Ваальс әлеует, қайда р бұл екеуінің арасындағы қашықтық дипольдер.
Кванттық-механикалық осциллятор арқылы модельдеу
The ван дер Ваальс байланыстырушы энергияны басқа қарапайым физикалық сурет арқылы талдауға болады: электронның өз ядросы айналасындағы қозғалысын үш өлшемді қарапайым модельдеу гармоникалық осциллятор потенциалды энергиямен Vа:
қайда мe және ω сәйкесінше электронның массасы және тербеліс жиілігі.
Бұл атом металдың бетіне жақындап, адсорбция құрған кезде, бұл потенциалдық энергия Vа орын ауыстыруларында квадраттық болатын қосымша потенциалдық шарттар арқылы кескін зарядтарының есебінен өзгертіледі:
- (жоғарыдағы Тейлор кеңеюінен.)
Болжалды
әлеуеті шамамен жақындатылған
- ,
қайда
Егер біреу электронды негізгі күйде деп санаса, онда ван-дер-Ваальстың байланыс энергиясы мәні нөлдік нүктенің энергиясының өзгерісі болып табылады:
Бұл өрнек-нің табиғатын да көрсетеді З−3 ван-дер-Ваальс өзара әрекеттестігінің тәуелділігі.
Сонымен, атомды енгізу арқылы поляризация,
ван-дер-Ваальс әлеуетін одан әрі жеңілдетуге болады:
қайда
атомдық поляризациямен байланысты ван-дер-Ваальс тұрақтысы.
Сонымен қатар, жоғарыдағы Тейлор кеңеюіндегі төртінші ретті түзетуді (aCvЗ0) / (Z4), қайда а тұрақты болып табылады, біз анықтай аламыз З0 позициясы ретінде динамикалық кескін жазықтығы және алу
| Ол | Не | Ар | Кр | Xe | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Cv | З0 | Cv | З0 | Cv | З0 | Cv | З0 | Cv | З0 | |
| Cu | 0.225 | 0.22 | 0.452 | 0.21 | 1.501 | 0.26 | 2.11 | 0.27 | 3.085 | 0.29 |
| Аг | 0.249 | 0.2 | 0.502 | 0.19 | 1.623 | 0.24 | 2.263 | 0.25 | 3.277 | 0.27 |
| Ау | 0.274 | 0.16 | 0.554 | 0.15 | 1.768 | 0.19 | 2.455 | 0.2 | 3.533 | 0.22 |
Шығу тегі З0 электронды толқындық функцияның бетінен төгілуінен пайда болады. Нәтижесінде кеңістіктің координатасына сілтемені бейнелейтін кескін жазықтығының орны субстрат бетінен өзгеше және өзгертілген З0.
1 кестеде гелий ван-дер-Ваальс тұрақтысы үшін модельді есептеу Cv және динамикалық кескін жазықтығы З0 әр түрлі металл беттеріндегі сирек газ атомдарының Ұлғаюы Cv He-ден Xe-ге дейін барлық металл субстраттар атомнан туындайды поляризация сирек кездесетін газ атомдарының Динамикалық кескін жазықтығының орны үшін ол диэлектрлік функцияның жоғарылауымен азаяды және әдетте 0,2 order ретімен болады.
Физорбция потенциалы
Тіпті ван-дер-Ваалстың өзара әрекеттесуі тартымды, өйткені адсорбцияланған атом бетке жақындағанда электрондардың толқындық функциясы беттік атомдармен қабаттаса бастайды. Жақындаған атом мен беттік атомдардың толқындық функцияларының ортогоналдылығына байланысты жүйенің энергиясы артады.
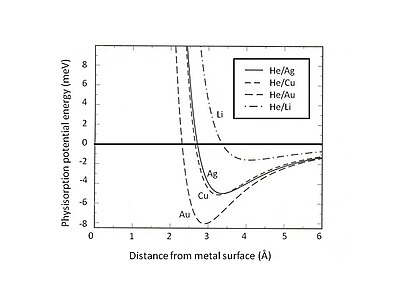
Бұл Паулиді алып тастау және итерілу әсіресе беттік өзара әрекеттесуінде басым болатын жабық валентті қабықшалары бар атомдар үшін күшті. Нәтижесінде, физорбцияның минималды энергиясын алыс диапазондағы ван-дер-Ваальс тарту мен қысқа диапазон арасындағы тепе-теңдік табу керек. Паулидің итермелеуі. Мысалы, физорбцияның өзара әрекеттесуін екі үлеске бөлу арқылы - қысқа мерзімді сипатталған Хартри – Фок Ван-дер-Ваальстің тартымдылығы мен теориясы - сирек кездесетін газдар үшін физорбцияның тепе-теңдік жағдайы гелий субстратты анықтауға болады.[5] 2 суретте Ag, Cu және Au субстраттарында адсорбцияланған He-дің физорбциялық потенциалдық энергиясы көрсетілген. гелий жағынды фонының әр түрлі тығыздығымен модель. Ван-дер-Ваалстың әлсіз өзара әрекеттесуі таяз тартымды энергетикалық ұңғымаларға әкелетінін анықтауға болады (<10 меВ). Физорбция потенциалының энергиясын зерттеудің тәжірибелік әдістерінің бірі - шашырау процесі, мысалы, металл бетінен шашыраған инертті газ атомдары. Шашыранды атомдар мен беттің арасындағы өзара әрекеттесу потенциалының белгілі бір ерекшеліктерін эксперименттік түрде анықталған бұрыштық үлестіруді және шашыраңқы бөлшектердің көлденең қималарын талдау арқылы алуға болады.
Кванттық механикалық - термодинамикалық модельдеу бетінің ауданы мен кеуектілігі үшін
1980 жылдан бастап адсорбцияны түсіндіру және жұмыс істейтін теңдеулер алу үшін екі теория жұмыс істеді. Бұл екеуі Чи гипотезасы, кванттық механикалық туынды және ESW Extreme Surface Work деп аталады.[6]. Екі теория да тегіс беттер үшін бірдей теңдеу береді:
Қайда U бірлік қадам функциясы болып табылады. Басқа белгілердің анықтамалары келесідей:

мұндағы «жарнамалар» «адсорбцияланған», «м» «бір қабатты эквиваленттілік» және «вап» дегенді білдіреді, бұл қатты сынамамен бірдей температурада сұйықтық адсорбтивінің бу қысымына сілтеме жасайды. Бірлік функциясы бірінші адсорбцияланған молекула үшін адсорбцияның молярлық энергиясының анықтамасын жасайды:
Сюжеті қарсы адсорбцияланған хи сюжет деп аталады. Тегіс беттер үшін хи учаскесінің көлбеуі бетінің ауданын береді. Эмпирикалық түрде бұл сюжет Поланиидің изотермасына өте жақсы сәйкес келетіндігі туралы байқалды[7][8][9] сонымен қатар deBoer және Zwikker[10] бірақ қуған жоқ. Бұған бұрынғы іс бойынша Эйнштейн, ал екінші жағдайда Брунауэр сын айтқан. Бұл тегіс беттік теңдеуді салыстыру қисықтарының әдеттегі дәстүрінде «стандартты қисық» ретінде пайдалануға болады, тек кеуекті үлгінің графиктің алғашқы бөлігі қарсы өзіндік стандарт ретінде әрекет етеді. Осы әдістің көмегімен ультрамикропоралы, микропоралы және мезопоралы жағдайларды талдауға болады. Толық изотермиялық үйлесімділіктің типтік стандартты ауытқулары кеуекті үлгілерді қоса алғанда, әдетте 2% -дан аз.
Біртекті кеуекті емес бетіндегі жақсы деректерге типтік сәйкестік 3 суретте көрсетілген. Деректер Пейн, Синг және Түрік[11] және жасау үшін пайдаланылды -s стандартты қисық. BET-тен айырмашылығы, ол тек ең жақсы жағдайда 0,05 - 0,35 аралығында болуы мүмкін P/Pvap, сәйкес келу диапазоны - толық изотерма.
Хемосорбциямен салыстыру
- Физорбция жалпы құбылыс болып табылады және кез-келген қатты / сұйық немесе қатты / газ жүйесінде болады. Химосорбция химиялық ерекшелігімен сипатталады.
- Физорбция кезінде адсорбент пен адсорбаттың электронды күйлерінің тітіркенуі минималды болады. Адсорбциялық күштерге Лондон күштері, диполь-диполь аттракциондары, диполь әсерінен тартылыс және «сутектік байланыс» жатады. Химосорбция үшін электронды күйлердегі өзгерістер физикалық құралдармен, басқаша айтқанда химиялық байланыс арқылы анықталуы мүмкін.
- Физорбцияның типтік байланыс энергиясы шамамен 10-300 меВ құрайды және локализацияланбаған. Химосорбция әдетте 1–10 эВ энергиямен байланысады және локализацияланған.
- Газ фазасынан физорбцияның қарапайым сатысы активтендіру энергиясын қамтымайды. Химосорбция көбінесе активтендіру энергиясын қамтиды.
- Физорбция үшін газ фазасының молекулалары үшін адсорбаттар кеуектілік сияқты физикалық кедергілер кедергі жасамаса, көп қабатты адсорбцияны түзеді. Химосорбцияда молекулалар бетінде валенттік байланыстармен адсорбцияланып, тек бір қабатты адсорбцияны құрайды.
- Атом күші микроскопының ұшына СО молекуласын бекіту және оның бір темір атомымен өзара әрекеттесуін өлшеу арқылы физорбциядан хемисорбцияға тікелей ауысу байқалды. * Хубер, Ф .; т.б. (12 қыркүйек 2019). «Физорбциядан хемисорбцияға ауысуды көрсететін химиялық байланыс түзілуі». Ғылым. 365 (хх): хх. Бибкод:2019Sci ... 365..xxxE. дои:10.1126 / science.aay3444. PMID 25791086. Бұл әсер 1960 жылдардың соңында далалық шығарындылар мен ЭТЖ өлшемдерінен байқалды және Мойес пен Уэллс хабарлады.[12]
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ K. Oura; т.б. (2003), Беттік ғылым, кіріспе, Берлин: Шпрингер, ISBN 978-3-540-00545-2
- ^ М.С.Десжонкерес; т.б. (1996), Беттік физикадағы түсініктер (2-ші басылым), Нью-Йорк: Спрингер-Верлаг, ISBN 978-3-540-58622-7, алынды 29 тамыз 2012
- ^ Ганс Лут; т.б. (1993), Қатты денелердің беттері мен интерфейстері, Springer-Verlag, ISBN 978-3-540-56840-7
- ^ Күз; т.б. (2000), «Жалғыз гекконның аяқ шашының жабысқақ күші», Табиғат, 405 (6787): 681–5, Бибкод:2000 ж.т.405..681А, дои:10.1038/35015073, PMID 10864324
- ^ а б Э. Заремба және В.Кон (1977), «Жай және асыл металдар бетіндегі гелий адсорбциясы теориясы», Физ. Аян Б., 15 (4): 1769–1781, Бибкод:1977PhRvB..15.1769Z, дои:10.1103 / PhysRevB.15.1769
- ^ Кондон, Джеймс (2020). Физорбция әдісімен беттің ауданы мен кеуектілігін анықтау, 2-ші басылым. Өлшеу, классикалық теория және кванттық теория. Amsterdam.NL: Elsevier. 3, 4 және 5 тараулар. ISBN 978-0-12-818785-2.
- ^ Полании, М. (1914). Верк. Deutsch. Физик, газ. 16: 1012. Жоқ немесе бос
| тақырып =(Көмектесіңдер) - ^ Полании, М. (1920). «Neueres über Adsorption und Ursache der Adsorptionskräfte». Электрохимия. 26: 370–374.
- ^ Полании, М. (1929). «Grundlagen der Potentialtheorie der Adsorption». Z Electrohem. 35: 431–432.
- ^ deBoer, J.H .; Цвиккер, C. (1929). «Адсорбция және фолге фон поляризациясы». З. физ. Хим. B3: 407–420.
- ^ Пейн, Д.А .; Ән айт, K. S. W .; D. H. Turk (1973). «Кеуекті және порозды емес гидроксилденген кремнеземдегі аргон және азот адсорбция изотермаларын салыстыру». Дж. Коллоидты интерфейс. 43: 287.
- ^ Мойес, М.Л .; Монсон, П.А. (1973). «Бензолдың металдарға адсорбциясы». Adv. Катал. 20: 591–622.