Метан - Methanium - Wikipedia
 «Нағыз» метан, метаболиттік өтпелі мемлекет CH+ 5 | |
 Метан, CH 3(H 2)+ | |
| Атаулар | |
|---|---|
| Басқа атаулар карбоний (бірнеше анықтамалардан бас тартқан)[1] | |
| Идентификаторлар | |
3D моделі (JSmol ) |
|
| |
| |
| Қасиеттері | |
| CH5+ | |
| Молярлық масса | 17.050 г · моль−1 |
| Біріктірілген негіз | Метан |
| Құрылым | |
| тригональды бипирамидалы | |
Өзгеше белгіленбеген жағдайларды қоспағанда, олар үшін материалдар үшін деректер келтірілген стандартты күй (25 ° C [77 ° F], 100 кПа). | |
| Infobox сілтемелері | |
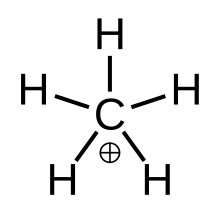
Жылы химия, метаний күрделі болып табылады оң ион формуласымен [CH
3(H
2)]+, атап айтқанда, біреуі бар молекула көміртегі атом байланыстырылған үшке сутегі атомдары және сутегі молекуласы +1 электр заряды. Бұл суперқышқыл және бірі оний иондары, шынымен де қарапайым карбоний ионы.
Метаниумды зертханада сирек кездесетін газ түрінде немесе суперқышқылдарда сұйылтылған түр түрінде өндіруге болады. Ол алғаш рет 1950 жылы дайындалып, 1952 жылы басылған Виктор Тальроуз және оның көмекшісі Анна Константиновна Любимова.[2][3] Бұл ан түрінде болады аралық түрлер химиялық реакцияларда.
Метаниум ионы есімімен аталады метан (CH
4) туындысымен ұқсастығы бойынша аммоний ионы (NH+
4) бастап аммиак (NH
3).
Құрылым
Метаниумды а ретінде бейнелеуге болады CH+
3 карбениум ионы бірге өзара әрекеттесетін сутегі молекуласы а-дағы бос орбитамен 3-центр-2-электронды байланыс. Н-да байланысатын электрондар жұбы2 молекула 3-центр-2-электронды байланыс түзетін екі сутек пен бір көміртек атомдары арасында бөлінеді.[4]
Н-дағы екі сутек атомы2 молекула үштегі сутегі атомдарымен позицияларды үздіксіз алмастыра алады CH+
3 ион (конформациялық өзгеріс деп аталады жалған сөз, атап айтқанда Жидек механизмі ). Сондықтан метаниум ионы а деп саналады флюсионалды молекула. Айырбастау үшін энергия кедергісі өте төмен және өте төмен температурада да болады.[5][6]
Инфрақызыл спектроскопия метан ионының әртүрлі конформациялары туралы ақпарат алу үшін қолданылған.[7][8][9] Қарапайым метанның ИҚ-спектрінде симметриялы және асимметриялық 3000 С-ға созылған екі C-H жолағы бар.−1 және екі жолақ шамамен 1400 см−1 иілудің симметриялы және асимметриялық тербелістерінен. Спектрінде CH+
5 созылуының үш асимметриялық тербелісі шамамен 2800-3000 см−1, тербеліс 1300 см−1және иілу тербелісі 1100 1300 см−1.
Дайындық
Метанды метаннан өте күшті қышқылдардың әсерінен дайындауға болады, мысалы фторантимон қышқылы (пентафторлы сурьма SbF
5 жылы фтор сутегі HF).[10]
Шамамен 270 Па метан ионы, қысым мен қоршаған орта температурасы CH+
4 метан алу үшін бейтарап метанмен әрекеттеседі және а метил радикалы:[11]
- CH+
4 + CH
4 → CH+
5 + CH•
3
Тұрақтылық және реакциялар
Метанды реакция нәтижесінде алынған катиондар SbF
5 + HF HF молекулаларымен өзара әрекеттесу арқылы тұрақталады.
Төмен қысымдарда (шамамен 1 мм.с.б.) және қоршаған орта температурасында метаний бейтарап метанға реактивті емес.[11]
Әдебиеттер тізімі
- ^ Химия, таза және қолданбалы халықаралық одақ (2009). карбоний ионы. IUPAC химиялық терминологияның жинақтамасы. IUPAC. дои:10.1351 / goldbook.C00839. ISBN 978-0-9678550-9-7. Алынған 27 қараша 2018.
- ^ V. L. Talrose және A. K. Lyubimova, Dokl. Акад. Nauk SSSR 86, 909-912 (1952) (Орыс тілінде: Тальрозе, В. Л., және А. К. Любимова. «Вторичные процессы в ионном источнике масс-спектрометра.» ДАН СССР 86 (1952): 909-912)
- ^ Николаев, Евгений (1998). «Виктор Тальроуз: алғыс». Бұқаралық спектрометрия журналы. 33 (6): 499–501. Бибкод:1998JMSp ... 33..499N. дои:10.1002 / (SICI) 1096-9888 (199806) 33: 6 <499 :: AID-JMS684> 3.0.CO; 2-C. ISSN 1076-5174.
- ^ Расул, Голам; Пракаш, Г.К. Сурья; Олах, Джордж А. (2011). «Карбоний гиперкординат иондары мен олардың аналогтарын салыстырмалы зерттеу: спектроскопистер үшін қиындық». Химиялық физика хаттары. 517 (1–3): 1–8. Бибкод:2011CPL ... 517 .... 1R. дои:10.1016 / j.cplett.2011.10.020.
- ^ Шрайнер, Питер Р .; Ким, Сын Джун; Шефер, Генри Ф .; фон Рагу Шлейер, Пол (1993). «CH+
5: Аяқталмайтын оқиға немесе соңғы сөз бе? «. Химиялық физика журналы. 99 (5): 3716–3720. дои:10.1063/1.466147. - ^ Мюллер, Хендрик; Кутцельнигг, Вернер; Нога, Йозеф; Клоппер, Вим (1997). «CH5 +: Оқиға жалғасуда. Бір-бірімен нақты байланыстырылған кластерлік зерттеу». Химиялық физика журналы. 106 (5): 1863. дои:10.1063/1.473340.
- ^ Уайт, Эдмунд Т .; Тан, Цзянь; Ока, Такеши (1999). «CH+
5: Инфрақызыл спектр байқалды ». Ғылым. 284 (5411): 135. Бибкод:1999Sci ... 284..135W. дои:10.1126 / ғылым.284.5411.135. PMID 10102811. - ^ Оскар Асвани, Падма Кумар П; Редлич, Бритта; Гегеманн, Илка; Шлеммер, Стефан; Маркс, Доминик (2005). «Жалаңаштың инфрақызыл спектрін түсіну CH+
5". Ғылым. 309 (5738): 1219–1222. Бибкод:2005Sci ... 309.1219A. дои:10.1126 / ғылым.1113729. PMID 15994376. S2CID 28745636. - ^ Хуан, Синчуан; Маккой, Анн Б .; Боуман, Джоэль М.; Джонсон, Линдсей М .; Savage, Chandra; Донг, Фэн; Несбит, Дэвид Дж. (2006). «Инфрақызыл спектрінің кванттық деконструкциясы CH+
5". Ғылым. 311 (5757): 60–63. Бибкод:2006Sci ... 311 ... 60H. дои:10.1126 / ғылым.1121166. PMID 16400143. S2CID 26158108. - ^ Соммер, Дж .; Джост, Р. (2000). «Карбоний және карбоний иондары сұйық және қатты қышқыл-катализденген кіші алкандарды активтендіруде» (PDF). Таза және қолданбалы химия. 72 (12): 2309–2318. дои:10.1351 / pac200072122309. S2CID 46627813.
- ^ а б Филд, Ф. Х .; Мунсон, M. S. B. (1965). «Газ тәрізді иондардың реакциясы. XIV. Метанды 2 Торрға дейінгі қысыммен масс-спектрометриялық зерттеу». Американдық химия қоғамының журналы. 87 (15): 3289–3294. дои:10.1021 / ja01093a001.
