Гистидин фосфотрансферінің домені - Histidine phosphotransfer domain - Wikipedia
| Гистидин фосфотрансферінің домені | |||||||||
|---|---|---|---|---|---|---|---|---|---|
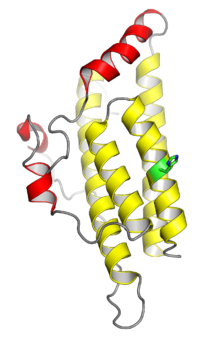 The кристалдық құрылым ашытқы гистидинфосфотрансфераза ақуызының Ypd1. Сары түспен көрсетілген төрт спираль консервіленгендерді құрайды төрт бұрандалы байлам мономерлік HPt домендеріне тән; қызыл түспен көрсетілген спиральдар Ypd1 үшін кірістіру болып табылады. Гистидинді фосфорлану орны жасыл түспен көрсетілген. Қайдан PDB: 1С02.[1] | |||||||||
| Идентификаторлар | |||||||||
| Таңба | Hpt | ||||||||
| Pfam | PF01627 | ||||||||
| InterPro | IPR008207 | ||||||||
| SMART | HPT | ||||||||
| PROSITE | PS50894 | ||||||||
| |||||||||
| Гистидинфосфотрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристалл құрылымы Caulobacter crescentus гистидинфосфотрансфераза ақуызы ChpT димерлі түрде. Сары түспен көрсетілген төрт спираль консервіленген төрт спиральды шоғырдан тұрады, гистидинді фосфорлану орындары жасыл түспен ерекшеленеді. Қызыл және күңгірт түстермен көрсетілген домендер - бұл гистидинкиназалардың ATP байланыстыратын домендеріне ұқсайтын жалған-CA домендер, бірақ ATP-ді байланыстырмайды немесе гидролизденбейді. Қайдан PDB: 4FMT.[2] | |||||||||
| Идентификаторлар | |||||||||
| Таңба | HPTransfase | ||||||||
| Pfam | PF10090 | ||||||||
| InterPro | IPR018762 | ||||||||
| |||||||||
Гистидинфосфотрансфердің домендері және гистидинфосфотрансферазалар (екеуі де жиі қысқартылады HPt) болып табылады белоктық домендер «фосфорелей» түріне қатысады екі компонентті реттеу жүйелері. Бұл белоктар а фосфорланатын гистидин қалдық және тасымалдауға жауап береді фосфорил тобы ан аспартат аралық «қабылдағыштағы» қалдық домен, әдетте гибридтің бөлігі гистидинкиназа, финалдағы қатысушыға жауап реттеушісі.
Функция
Православиелік екі компонентті сигнализацияда а гистидинкиназа ақуыз автофосфорилаттар үстінде гистидин жасушадан тыс сигналға жауап ретінде қалдық және фосфорил тобы кейіннен аспартат а. қабылдағыш доменіндегі қалдық жауап реттеушісі. Фосфорелейлерде «гибридті» гистидинкиназа құрамында фосфорил тобы берілетін ішкі құрамында аспартаты бар қабылдағыш домені бар, содан кейін құрамында фосфорланатын гистидин бар HPt ақуызы фосфорил тобын алады және ақыр соңында оны жауап реттеушісіне береді. Эстафета жүйесі осылайша His-Asp-His-Asp ретімен жүреді, ал екіншісі оның Hpt үлесімен.[3][4][5] Кейбір жағдайларда фосфорелей жүйесі гистидин киназасының ішкі қабылдағышы бар гибридті гөрі емес, төрт бөлек ақуыздан құрылады, ал басқа мысалдарда гистидинкиназа полипептидтік тізбегінде қабылдағыш та, HPT домендері де болады.[6]:198 Екі компонентті жүйелік домендік архитектураны санау нәтижесінде бактериялардағы HPt домендері жеке белоктарға қарағанда үлкенірек белоктардың домендері ретінде жиі кездеседі.[4]
Реттеу
Ортодоксалды екі компонентті сигнализациямен салыстырғанда фосфорелей жүйесінің күрделілігінің жоғарылауы реттеу үшін қосымша мүмкіндіктер береді және жауаптың ерекшелігін жақсартады.[6]:192[7] Православиелік екі компонентті жүйелер арасында өте аз өзара сөйлесу болғанымен, фосфорелейлер сигнал беру жолдарын күрделендіреді; мысал ретінде, ағынның ағынында бірнеше шығысы бар бифуркацияланған жол бар Caulobacter crescentus ChpT HPt қатысады жасушалық цикл реттеу,[2] немесе, балама, бірнеше гистидинкиназа сияқты бір реакция реттегішін басқаратын жолдар, мысалы спорация жол Bacillus subtilis, бұл уақытша күрделі вариацияларды тудыруы мүмкін.[8] Кейбір белгілі жағдайларда фосфогистидиннің қосымша реттеу түрі бар фосфатаза сияқты HPT-ге әсер ететін ферменттер Ішек таяқшасы ақуыз АлтыА қандай мақсаттар ArcB.[6]:206
Құрылым

Гистидинфосфотрансфер функциясын а-дан тұратын кем дегенде екі түрлі архитектурасы бар ақуыздар жүзеге асыра алады төрт бұрандалы байлам бірақ буманы құрастыру тәсілімен ерекшеленеді. Құрылымдық жағынан сипатталатын HPt ақуыздары, мысалы Hpt домені Ішек таяқшасы ақуыз ArcB және Saccharomyces cerevisiae ақуыз Ypd1, буманы мономерлер түрінде құрайды.[5][2] Сияқты сирек кездесетін типте Bacillus subtilis спорация фактор Spo0B немесе Caulobacter crescentus ақуыз ChpT, бума а түрінде құрастырылады ақуыз димері, гистидин киназаларының құрылысымен ұқсастық.[7][2] Мономикалық HPt домендері тек бір фосфорланатын гистидин қалдықтарына ие және бір реакция реттегішімен әрекеттеседі, ал димерлерде екі фосфорлану орны бар және бір уақытта екі реакция реттегіштерімен әрекеттесе алады. Мономикалық HPt домендерінде жоқ ферментативті өз қызметтері және тек фосфат шаттлдарының рөлін атқарады,[10][4] ал Spo0B димерлі каталитикалық болса; оның фосфотрансфертің реципиентке реакция реттегішіне түсуі гистидинфосфатпен салыстырғанда күрт жеделдейді.[11] Екінші доменге ие болғанына қарамастан ATPase домендер, димеритті HPt ақуыздары АТФ-ты байланыстыратыны немесе гидролиздейтіні және басқа ATPase-де болатын негізгі қалдықтардың болмағаны дәлелденбеген.[2]
Мономерлі және димерлі формалардың анықталатын түрі жоқ дәйектілік ұқсастығы және, мүмкін, эволюциялық байланысты емес; олар орнына мысалдар конвергентті эволюция.[2] Димерлі ГПЦ, мүмкін, деградацияланған гистидинкиназдардан пайда болғанымен, мономерлі ГПЦ-тердің шығу тегі бірқатар болуы мүмкін, өйткені құрылымда эволюциялық шектеулер аз.[3]
Тарату
Жылы бактериялар, онда екі компонентті сигнал беру өте кең таралған, белгілі гистидинкиназалардың шамамен 25% -ы гибридтік типке жатады. Екі компонентті жүйелер сирек кездеседі архей және эукариоттар және төменгі эукариоттарда және өсімдіктерде кездеседі, бірақ ондай емес метазоаналар. Белгілі мысалдардың ішінде, егер эукариоттық екі компонентті жүйелердің барлығы бірдей болмаса, гибридті киназа фосфорелейлері болып табылады.[3]
A биоинформатикалық бактериялық санақ геномдар әр түрлі бактерияларда анықталған (мономерлі) HPt домендерінің санында үлкен ауытқуларды тапты фила, кейбір геномдар НРС-ті мүлдем кодтамайды. Геномда болатын гистидинкиназа мен реакция реттегіштерінің санына қатысты, эукариоттарда бактерияларға қарағанда HPt домендері көп анықталады.[12] Жылы саңырауқұлақтар, HPt ақуыздарының геномдық тізімдемесі әр түрлі болады жіп тәрізді саңырауқұлақтар қарағанда көп HPt ақуызына ие ашытқылар; тек біреуі жақсы сипаттамада кодталған Saccharomyces cerevisiae геном. Өсімдіктерде әдетте бірнеше ГТ бар, бірақ реактивті реттеушілерге қарағанда аз.[4][10]
Әдебиеттер тізімі
- ^ Song HK, Lee JY, Lee MG, Moon J, Min K, Yang JK, Suh SW (қараша 1999). «Saccharomyces cerevisiae-ден Ypd1p кристалды құрылымымен анықталған эукариоттық көп сатылы фосфорелейлік сигналды беру туралы түсінік». Молекулалық биология журналы. 293 (4): 753–61. дои:10.1006 / jmbi.1999.3215. PMID 10543964.
- ^ а б c г. e f Блэр Дж.А., Сю Q, Чилдерс WS, Мэттьюс II, Керн JW, Эккарт М, Дикон AM, Шапиро L (қыркүйек 2013). «Маңызды бактериялық жасушалық циклдік фосфотрансфер ақуызының сигналдық сымдары». Құрылым. 21 (9): 1590–601. дои:10.1016 / j.str.2013.06.024. PMC 3787845. PMID 23932593.
- ^ а б c Capra EJ, Laub MT (2012). «Екі компонентті сигнал беру жүйелерінің эволюциясы». Микробиологияға жыл сайынғы шолу. 66: 325–47. дои:10.1146 / annurev-micro-092611-150039. PMC 4097194. PMID 22746333.
- ^ а б c г. Surujon D, Ratner DI (2016). «Гистидин фосфотрансферінің құрамында домен бар ақуыздарды анықтау үшін ықтимал мотивтік іздеуді қолдану». PLOS ONE. 11 (1): e0146577. Бибкод:2016PLoSO..1146577S. дои:10.1371 / journal.pone.0146577. PMC 4709007. PMID 26751210.
- ^ а б Xu Q, Carlton D, Miller MD, Elsliger MA, Кришна С.С., Абдубек П, Астахова Т, Бурра Р, Чиу Х.Ж., Клейтон Т, Деллер MC, Дуан Л, Элиас Ю, Фейерхельм Дж, Грант Дж.К., Гржечник А, Гржечик С.К. , Хан Г.В., Ярошевский Л, Джин К.К., Клок Х., Кнут МВ, Козбиал П, Кумар А, Марчиано Д, МакМуллан Д, Морзе AT, Нигогоссиан Е, Окач Л, Ооммахен С, Полсен Дж, Рейес Р, Райф Кл, Сефкович. N, Trame C, Trout CV, van den Bedem H, Weekes D, Hodgson KO, Wooley J, Deacon AM, Godzik A, Lesley SA, Wilson IA (шілде 2009). «Гистидинфосфотрансфер ақуызының кристалдық құрылымы ShpA, Caulobacter crescentus-тағы сабақ биогенезінің маңызды реттеушісі». Молекулалық биология журналы. 390 (4): 686–98. дои:10.1016 / j.jmb.2009.05.023. PMC 2726009. PMID 19450606.
- ^ а б c Уитуорт, Дэвид Э. (2012). «Прокариоттардағы екі компонентті реттеуші жүйелер». Filloux-те Ален А.М. (ред.). Бактериялық реттеуші желілер. Норфолк, Ұлыбритания: Caister Academic Press. 191–222 бб. ISBN 9781908230034.
- ^ а б Варугезе К.И. (сәуір 2002). «Бактериялық фосфорелей ақуыздарының молекулалық танылуы». Микробиологиядағы қазіргі пікір. 5 (2): 142–8. дои:10.1016 / s1369-5274 (02) 00305-3. PMID 11934609.
- ^ Salazar ME, Laub MT (сәуір 2015). «Екі компонентті сигнал беру жолдарының уақытша және эволюциялық динамикасы» (PDF). Микробиологиядағы қазіргі пікір. 24: 7–14. дои:10.1016 / j.mib.2014.12.003. hdl:1721.1/105366. PMC 4380680. PMID 25589045.
- ^ Zhao X, Copeland DM, Soares AS, Батыс AH (қаңтар 2008). «YPD1 фосфоролей ақуызы мен фосфорил аналогымен байланысқан SLN1 реакциясының реттегіш домені арасындағы комплекстің кристалдық құрылымы». Молекулалық биология журналы. 375 (4): 1141–51. дои:10.1016 / j.jmb.2007.11.045. PMC 2254212. PMID 18076904.
- ^ а б Fassler JS, Батыс AH (тамыз 2013). «Саңырауқұлақты екі компонентті сигналды өткізу жолдарындағы гистидинфосфотрансфер белоктары». Эукариотты жасуша. 12 (8): 1052–60. дои:10.1128 / ec.00083-13. PMC 3754533. PMID 23771905.
- ^ Zapf J, Sen U, Hoch JA, Varughese KI (тамыз 2000). «Кристалл торына түскен екі фосфорелей ақуызының арасындағы уақытша әсерлесу сигналды өткізуде молекулалық тану және фосфотрансфер механизмін ашады». Құрылым. 8 (8): 851–62. дои:10.1016 / s0969-2126 (00) 00174-x. PMID 10997904.
- ^ Salvado B, Vilaprinyo E, Sorribas A, Alves R (2015). «HK, HPt және RR домендерін зерттеу және оларды екі компонентті жүйелерде және геномдары толығымен тізбектелген организмдердің фосфоролейлі белоктарында ұйымдастыру». PeerJ. 3: e1183. дои:10.7717 / peerj.1183. PMC 4558063. PMID 26339559.
