Дивинилциклопропан-циклогептадиенді қайта құру - Divinylcyclopropane-cycloheptadiene rearrangement - Wikipedia
The дивинилциклопропан-циклогептадиенді қайта құру бұл 1,2-дивинилциклопропанның циклогептадиенге немесе -триенге изомерленуін қамтитын органикалық химиялық трансформация. Бұл концептуалды байланысты Қайта ұйымдастыруды жеңу, бірақ сақиналық деформацияның шығуына байланысты күшті термодинамикалық қозғаушы күштің артықшылығы бар. Бұл термодинамикалық қуат жақында баламалы энергия көзі ретінде қарастырылуда.[1]
Кіріспе
1960 жылы Фогель 1,2-дивинилциклопропанның циклогептан-1,4-диенге қайта оралатынын анықтады.,[2] Ол ашқаннан кейін 1960 ж. Реакциялардың қарқынды механистикалық зерттеулері жүрді, өйткені зерттеушілер оның осыған байланысты (құрылымдық та, механикалық та) ұқсастығын түсінді. қайта құру винилциклопропаннан циклопентенге дейін. 1970 ж. Қайта құру синтетикалық утилитке қол жеткізді[3] және осы күнге дейін ол жеті мүшелі сақиналарды қалыптастыру үшін пайдалы әдіс болып қала береді. Гетероатомдарды қосатын вариациялар туралы хабарлады (төменде қараңыз).
(1)

Артықшылықтары: Қайта құру болғандықтан, процесс атом экономикасын көрсетеді. Ол көбінесе катализаторды қажет етпей өздігінен жүреді. Бүкіл көміртекті қайта құру үшін бәсекелестік жолдар өте аз.
Кемшіліктері: Бастапқы материалдардың конфигурациясы көптеген жағдайларда бақылануы керек -транс-дивинилциклопропандар қайта түзілу алдында изомерлеуді жеңілдету үшін жиі қыздыруды қажет етеді. Гетероатомдарды қамтитын қайта құрылымдау бүйірлік өнімдердің пайда болуына байланысты төмендеген өнімділікті көрсете алады.
Механизм және Стереохимия
Басым механизм
Қайта құру механизміне қатысты алғашқы пікірталас бұл келісілген (сигматропты) немесе сатылы (дирадикалық) процесс пе екендігі туралы. Механикалық тәжірибелер осыны көрсетті транс-дивинилциклопропандар сәйкес келеді cis изомерлерді өзгертеді және мүмкін болатын жол арқылы қайта құрылымдаудан өтеді.[4][5] Қайық тәрізді өтпелі күй ұсынылды және бұл процестің байқалған стереоспецификасын түсіндіруге көмектеседі. Бастапқы эпимеризациясы ма транс субстраттар бір немесе екі орталық процесс арқылы жүреді, көп жағдайда түсініксіз.
(2)

Қайта құрылымдаудың өтпелі-метал-катализденген нұсқалары белгілі және механизмдер әр түрлі. Бір мысалда родий бис (этилен) гексафторороцетилацетонатты қолдану, координация және бис-π-аллил кешенінің түзілуі электроциклдік сақинаның жабылуы мен катализатордың шығуы алдында.[6]
(3)

Стереоселективті нұсқалар
Ауыстырылған қос байланысы бар дивинилциклопропанның реакциясы қос байланыстағы конфигурацияға қатысты стереоспецификалық болып табылады -cis,cis изомерлер береді cis өнімдер, ал cis,транс изомерлер транс өнімдерін береді. Осылайша, хиральды, рацемиялық емес бастапқы материалдар энантиомерлік тазалықты жоғалтпастан хираль өнімдерін тудырады. Төмендегі мысалда әр жағдайда тек изомерлер бейнеленген.[7]
(4)

Қолдану аясы және шектеулер
Дивинилциклопропанның алуан түрлілігі титулды реакцияға түседі. Бұл прекурсорлар циклопропилді нуклеофилдерді (литий тұздары,[8] немесе мыс[9]) белсендірілген екі немесе үштік байланыстарға, бис (2-галоэтил) циклопропандарды жою[10] және циклопропанация.[11]
Төмендегі мысалда купрат қосылуын жою уақытша енонды тудырады 1, ол спиросциклге қайта оралады 2.
(5)
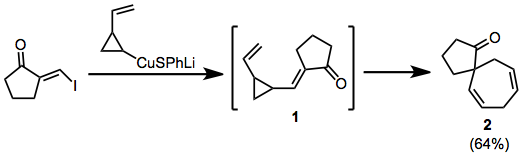
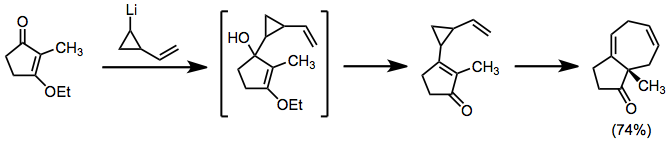
Органолитийлерді де осындай рөлде қолдануға болады, бірақ карбонилдерге тікелей қосылады. Біріктірілген топологиясы бар өнімдер.[8]
(6)
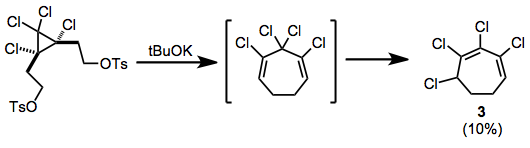
Дитозилаттарды шығарғаннан кейін қайта құру байқалды; осылайша өндірілген хлорланған циклогептадиен конъюгацияланған гептадиенге изомерленеді 3 реакция кезінде.[10]
(7)
Конъюгацияланған диазо қосылыстарымен циклопропанация дивинилциклопропандарды түзеді, содан кейін олар қайта құрылымға түседі. Циклдік бастапқы материалдар пайдаланылған кезде көпірлі өнім пайда болады.[12]
(8)

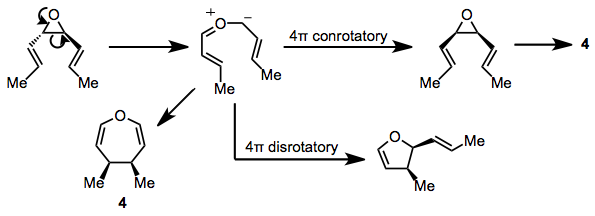
Үш мүшелі гетероциклді сақиналары бар субстраттар реакцияға түсуі де мүмкін. cis-Дивинилепоксидтер оксепиндерді жоғары температурада береді (100 ° C). транс Изомерлер карбонилдің делдалдығы арқылы дигидрофурандарға қызықты бәсекелік қайта құрудан өтеді иллид[13] және сол илидиді аралық зат оксепин өнімінің тікелей ізашары ретінде ұсынылған 4.[14] Біріктірілген диенил эпоксидтері иллиді аралық заттың болуына қолдау көрсетіп, ұқсас өнімдер құрайды.[15]
(9)
Дивинил азиридиндер қамтамасыз ететін осындай реакциялар жиынтығынан өтеді азепиндер немесе винил пирролиндер азиридиннің бастапқы материалының салыстырмалы конфигурациясына байланысты.[16] Дивинил тиирандар қамтамасыз ете алады тиепиндер немесе дигидрофиофендер, бірақ бұл реакциялар сәйкесінше азот және оттегі бар қосылыстарға қарағанда баяу жүреді.
Синтетикалық қосымшалар
Циклогептадиенді титулды қайта құру арқылы алғашқы байқауды Бэйер өзінің синтезінде жасады. эвкарвон карвон гидробромидінен.[17] Механикалық зерттеулер бұл қайта құру келісілген, Cope типті механизм арқылы жүзеге асқанын анықтады.[18]
(10)

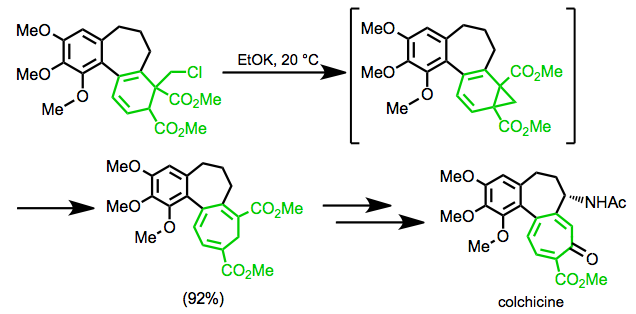
Эшенмосер синтезінде колхицин, қайта құру мақсаттың жеті мүшелі сақинасын қалыптастыру үшін қолданылады.[19]
(11)
Сирениннің рацемиялық синтезі а Виттиг реакциясы негізгі дивинилциклопропан түзу үшін. Қайта құру өнімін гидрогендеу мақсатқа қол жеткізді.[20]
(12)

Эксперименттік жағдайлар мен процедура
Типтік жағдайлар
Әдетте, қайта құру сол кастрюльде, дивинилциклопропан түзілгеннен кейін жүзеге асырылады. Жылыту кейде қажет, әсіресе қажет транс қайта құрылымдау алдында эпимеризациядан өтуі керек субстраттар. Активтендіру кедергілерінен өту үшін жеткілікті энергиямен, алайда, изомерлеу өте тиімді.
Мысал рәсімі[21]
(13)

Салқын (-78 °) дейін араластырылған ерітіндіге дейін литий диизопропиламид (1,4-1,5 ммоль / ммоль кетон) құрғақ күйде THF (4 мл / ммоль негіз) аргон атмосферасына баяу n-бутил-транс-2-винилциклопропил кетон (1,19 ммоль) ерітіндісі құрғақ күйде қосылды THF (1 мл / ммоль кетон), ал алынған ерітінді –78 ° температурада 45 минут араластырылды. Жаңа сублимацияланған терт-бутилдиметилсилил хлоридінің ерітіндісі (1,6 ммоль / ммоль кетон) құрғақ THF (1 мл / ммоль хлорид) қосылды, содан кейін құрғақ HMPA (0,5 мл / ммоль кетон). Ерітінді –78 ° температурада 15 минут және бөлме температурасында 2-3 сағат араластырылды, содан кейін оны қаныққан сулы бөліктерге бөлді. натрий гидрокарбонаты және пентан (Сәйкесінше 10 мл және 20 мл / ммоль кетон). Сулы фаза пентанмен екі рет жуылды. Аралас сығынды төрт рет қаныққан сулы натрий гидрокарбонатымен және екі рет жуылды тұзды ерітінді, содан кейін кептірілген (MgSO4 ). Еріткішті кетіру, содан кейін шамды шамға дейін қалған маймен айдау, сәйкесінше берді силил энол эфирі ИК карбонилінің сіңірілуін көрсетпейтін түссіз май ретінде. Силил энол эфирінің термолизі 230 ° (ауа-ванна температурасында) 30-60 минут қыздыру (таза, аргон атмосферасы) арқылы жүзеге асты. Алынған материалдардың тікелей дистилляциясы (140-150 ° / 12 торр) циклогептадиенді 85% кірістілікпен қамтамасыз етті: IR (фильм) 1660, 1260, 840 см – 1; 1H NMR (CDCl3 ) δ 0,09 (с, 6Н), 0,88 (с, 9Н), 0,7-2,75 (м, 14Н), 4,8 (t, 1H, J = 5,5 Гц), 5,5-5,9 (м, 2Н).
Әдебиеттер тізімі
- ^ Хадликки, Т .; Фан, Р .; Рид, Дж. В .; Гадамасетти, К.Г. Org. Реакция. 1992, 41, 1-133. дои:10.1002 / 0471264180.or041.01
- ^ Фогель, Э. Angew. Хим. 1960, 72, 4.
- ^ Вендер, П.А .; Эйзенстат, М.А .; Филоза, М. П. Дж. Хим. Soc. 1979, 101, 2196.
- ^ Арай, М .; Кроуфорд, Дж. Мүмкін. Дж.Хем. 1972, 50, 2158.
- ^ Болдуин, Дж. Э .; Флеминг, Р. Х.Дж. Хим. Soc. 1973, 95, 5256.
- ^ Алкок, Н.В .; Браун, Дж. М .; Конни, Дж. А .; Стофко, кіші, Дж. Дж. Дж.Хем. Soc., Chem. Коммун., 1975, 234.
- ^ Брюл, Д .; Чалчат, Дж. С .; Весьере, Р. Өгіз. Soc. Хим. Фр. 1978, Жоқ 7-8, II-385.
- ^ а б Вендер, П.А .; Филоза, М. П. Дж. Орг. Хим. 1976, 41, 3490.
- ^ Марино, Дж. П .; Браун, Л. Дж. Тетраэдр Летт. 1976, 3245.
- ^ а б Мюллер, П .; Рей, М. Хельв. Хим. Акта, 1982, 65, 1191.
- ^ Хадликки, Т .; Рулин, Ф .; Лавлас, Т .; Рид, Дж. В. Табиғи өнім химиясын зерттеу, Атта-ур-Рахман, Ред., Элсевье, Амстердам, 1989, Б бөлім, б. 3.
- ^ Дэвис, Х.Л .; Кларк, Д.М .; Смит, Т. Тетраэдр Летт. 1985, 26, 5659.
- ^ Поммелет, Дж. С .; Маниссе, Н .; Чуче, Дж. Тетраэдр, 1972, 28, 3929.
- ^ Браун, Р. Дж. Орг. Хим. 1963, 28, 1383.
- ^ Эбербах, В .; Розер, Дж. Тетраэдр Летт. 1987, 28, 2685.
- ^ Маниссе, Н .; Чуче, Дж. Тетраэдр, 1977, 33, 2399.
- ^ Байер, А. Бер. 1894, 27, 810; сол жерде. 1898, 31, 2067.
- ^ Фогель, Е .; Отт, К.-Х .; Гаджек, К. Джастус Либигс Анн. Хим. 1961, 644, 172.
- ^ Шрайбер, фон Дж.; Леймгрубер, В .; Песаро, М .; Шудель, П .; Трельфал, Т .; Эшенмосер, А. Хельв. Хим. Акта 1961, 44, 540.
- ^ Дженики, Л .; Акинтоби, Т .; Мюллер, Д.Г. Angew. Хим. Int. Ред. Энгл. 1971, 10, 492.
- ^ Пирс, Е .; Бурмистер, М. С .; Рейссиг, Х. У. Мүмкін. Дж.Хем. 1986, 64, 180.
