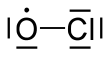Хлор тотығы - Chlorine monoxide - Wikipedia
Бұл мақалада жалпы тізімі бар сілтемелер, бірақ бұл негізінен тексерілмеген болып қалады, өйткені ол сәйкесінше жетіспейді кірістірілген дәйексөздер. (Сәуір 2020) (Бұл шаблон хабарламасын қалай және қашан жою керектігін біліп алыңыз) |
| |||
| Атаулар | |||
|---|---|---|---|
| IUPAC атауы Хлор тотығы | |||
| IUPAC жүйелік атауы Хлороксиданил | |||
| Басқа атаулар Хлор (II) оксиді | |||
| Идентификаторлар | |||
3D моделі (JSmol ) | |||
| Қысқартулар | ClO (.) | ||
| Чеби | |||
| ChemSpider | |||
| MeSH | Хлоросил | ||
PubChem CID | |||
| UNII | |||
CompTox бақылау тақтасы (EPA) | |||
| |||
| |||
| Қасиеттері | |||
| ClO | |||
| Молярлық масса | 51.45 г · моль−1 | ||
| Термохимия | |||
Std энтальпиясы қалыптастыру (ΔfH⦵298) | 101,8 кДж / моль[1] | ||
Өзгеше белгіленбеген жағдайларды қоспағанда, олар үшін материалдар үшін деректер келтірілген стандартты күй (25 ° C [77 ° F], 100 кПа). | |||
| Infobox сілтемелері | |||
Хлор тотығы химиялық зат радикалды химиялық формуламен . Процесінде маңызды рөл атқарады озон қабатының бұзылуы. Ішінде стратосфера, хлор атомдары реакцияға түседі озон хлор тотығын түзетін молекулалар және оттегі.
Бұл реакция озон қабатының бұзылуын тудырады.[1] Бұл нәтиже радикалдар келесідей әрекет ете алады:
хлор радикалын қалпына келтіру. Осылайша, озонның ыдырауының жалпы реакциясы хлормен катализделеді, өйткені соңында хлор өзгеріссіз қалады. Жалпы реакция:
Бұл қолданудың айтарлықтай әсері болды CFC жоғарғы стратосферада, дегенмен көптеген елдер CFC пайдалануға тыйым салуға келіскен. CFC реактивті емес табиғаты олардың стратосфераға өтуіне мүмкіндік береді, онда олар Cl-радикалдарын түзу үшін фото-диссоциациядан өтеді. Одан кейін олар хлор тотығын оңай түзеді және бұл цикл екіге дейін жалғасуы мүмкін радикалдар формаға реакция дихлор тотығы, радикалды реакцияны тоқтатады. CFC атмосферадағы концентрациясы өте төмен болғандықтан, реакцияның аяқталу ықтималдығы өте төмен, яғни әрбір радикал мыңдаған озон молекулаларын ыдырата алады.
Көптеген елдерде CFC қолдануға тыйым салынған болса да, CFC атмосферада шамамен 50-500 жыл бола алады. Бұл көптеген хлор радикалдарының пайда болуына әкеледі, сондықтан хлор радикалдары хлор оксидімен әрекеттесуге дейін озон молекулаларының едәуір бөлігі ыдырайды. Дихлор тотығы.
Әдебиеттер тізімі
- ^ а б Эгон Вайберг; Нильс Вайберг; Арнольд Фредерик Холлеман (2001). Бейорганикалық химия. Академиялық баспасөз. б. 462. ISBN 0-12-352651-5.
| Бұл бейорганикалық қосылыс - қатысты мақала а бұта. Сіз Уикипедияға көмектесе аласыз оны кеңейту. |