Азурин - Azurin
| Азурин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Азурин тетрамері, Pseudomonas aeruginosa | |||||||||
| Идентификаторлар | |||||||||
| Таңба | Мыс байланыстырушы | ||||||||
| Pfam | PF00127 | ||||||||
| SCOP2 | 5azu / Ауқымы / SUPFAM | ||||||||
| CDD | CD13922 | ||||||||
| |||||||||
Азурин кішкентай, периплазмалық, бактериалды көк мыс ақуызы табылды Псевдомонас, Бордетелла, немесе Алькалигендер бактериялар. Азурин бір электронды тасымалдауды басқарады ферменттер арасындағы тотығу-тотықсыздану процесі арқылы цитохром тізбегімен байланысты Cu (I) және Cu (II). Азурин тетрамерінің әрбір мономерінің молекулалық салмағы шамамен 14кДа, құрамында бір мыс атомы бар, интенсивті көгілдір және флуоресцентті сәулелену диапазоны 308 нм.
Азуриндер мен псевдоазуриндер қатысады денитрификация бактериялардағы процестер.[1] оның ішінде грамтеріс бактериялар Pseudomonas aeruginosa, c551 цитохромымен өзара әрекеттесу арқылы. Азурин P aeruginosa I типті көк мыс ақуызы (купредоксин), ал цитохром с551 (9 кДа) а хайм -қамту цитохром. Азурин белсенді учаскеге жақын жерде салыстырмалы түрде үлкен гидрофобты патчқа ие және бұл гидрофобты патчтың екі қалдықтары - Мет-44 және Мет-64 тотығу-тотықсыздану серіктестерімен өзара әрекеттесуге қатысады деп саналады цитохром с551 және нитрит редуктазы.[2]
Электронды тасымалдау қасиетімен байланысты болмаса да, азурин ісік-супрессор р53 ақуызымен өзара әрекеттесуі арқылы ісікке қарсы қасиетке ие екендігі анықталды.
Фермент механизмі
Тотыққан түрінде азурин (Cu2+Az) тотығу-тотықсыздану серіктесінен электрон алады және келесі реакцияға сәйкес азаяды:
Cu2+Az + e− -> Cu+Аз
Тотығу-тотықсыздану потенциалы 310 мВ құрайды.[3]
Өзара байланысты азуриннің бета-парағының құрылымы оның электронды тасымалдау орталығымен (мыс байланыстыратын жағы) берік байланысқан.[4] Азуриннің электронды тасымалдау механизмінде сутегі байланысы маңызды рөл атқарады деген көптеген тәжірибелік дәлелдер бар. Бұл бақылаулармен бірге электрондар туннель арқылы фермент арқылы полипептидті және сутектік байланыстарды бойлай өтеді, ал азуринді жасау ұзақ қашықтықтағы, интрапротеиндерді зерттеудің пайдалы модель жүйесі болып табылады. электронды тасымалдау (LRET).[4]
Ферменттердің құрылымы
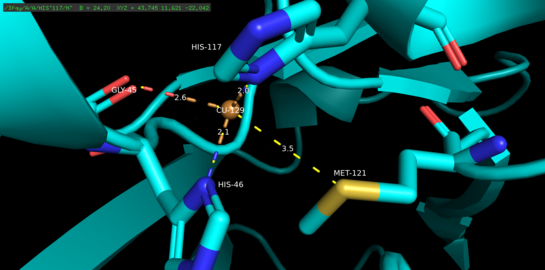
Азурин - тетрамерикалық ақуыз.[5] Әр мономердің салмағы шамамен 14кДа және бета-баррель түзілімінде орналасқан сегіз бета-тізбекті құрайтын 128 амин қышқылынан тұрады.[5] Жіптер бұрылыстармен және бір альфа-спиральді енгізу арқылы біріктіріледі.[5] Бір атомды мысты байланыстыратын учаске әр мономердің бетінен шамамен 7А төмен солтүстік ұшына қарай орналасқан; оны мекендейтін мыс атомы кең гидрофобты патчпен қоршалған бес лигандпен үйлеседі.[6]
Үш экваторлық мыс лигандары тиолаттан (Cys112) және екі имидазолдан (His46, His 117) тұрады, ал Gly45 және Met121 карбонилді оттегі атомдары екі әлсіз осьтік лигандалар қызметін атқарады.[5] Gly45 қоспағанда, жоғарыда мыс байланыстыратын конфигурация осы уақытқа дейін анықталған барлық 1-мыс байланыстыратын барлық ақуыздардың құрылымдарына тән.[7] Координацияланғаннан кейін лиганд-металл кешені бұрмаланған, тригоналды би-пирамидалы куприкалық (Cu (II)) тотығу деңгейіне қатысты ақуыздың купрустық (Cu (I)) төмендетілген күйін тұрақтандыратын геометрия.[5] Құрылымдық тұрғыдан жүктелген кері байланыс мыс d орбитальдары мен оның лиганд p орбиталдары арасында купустық күйді одан әрі тұрақтандыруы мүмкін.[8]
Азурин туралы қолданыстағы құрылымдық ақпарат көбіне ақуыздың мутацияланған формаларын рентгендік кристаллографиялық зерттеулерден алынған. Кристаллографияның көмегімен айқындалған құрылымдық ерекшеліктерге сегіз өзара бета-жіптен пайда болған бета-сэндвич мотиві жатады,[5] сонымен қатар бета-парақтарды 4 және 5 байланыстыратын бөшкеден тыс альфа-спиральды сегмент.[5]
Cu (I) / Cu (II) тотығу-тотықсыздану потенциалы азурин үшін басқа мыс кешендерінің көпшілігіне қарағанда жоғары болғанымен, Met121 (азуриннің экваторлық мыс координациялық лигандарының бірі) ауыстырылған құрылымдық зерттеулер тиолаттық мыс жоқтығын көрсетті. лиганд жоғары тотықсыздану потенциалдарын жоққа шығармайды, өйткені 121-позициядағы үлкен гидрофобты қалдықтар мыс атомының тотығу-тотықсыздану потенциалын жоғарылатады.[8] Осылайша, тотығу-тотықсыздану потенциалының жоғарылығы металды байланыстыратын жерден судың шығарылуына жатқызылды, бұл жағдай ірі гидрофобты қалдықтардың болуымен күшейе түсті.[8]
Керісінше, теріс зарядталған қалдықтар тотығу-тотықсыздану потенциалын төмендетеді, өйткені олар мыс ионының оң зарядталған купирлік түрін тұрақтандырады.[8]
Биологиялық функция
Азуратты бекітетін организмдерде көрсетілген кезде азурин электрондардың доноры ретінде қызмет етеді нитрит редуктазы, фермент денитрификация жолы азот айналымы.[9]
Азуриндер қолдайды тотығу дезаминациясы хош иістен электрондарды жіберу арқылы алғашқы аминдер амин дегидрогеназа дейін цитохромоксидаза, сондай-ақ кейбір с-түрінен цитохромдар нитрит редуктазаларына дейін.[10]
Аурудың өзектілігі
Азурин әр түрлі ауруларға, оның ішінде қатерлі ісікке қарсы терапевт ретінде маңызды назар аударды.[11] In vivo организмде минималды уытты әсерлері бар адамның меланомасы мен сүт безі қатерлі ісігі тіндерінің регрессиясын тудыратыны дәлелденді.[11]
Азурин ферменттің р28 домені арқылы рак клеткаларына жақсырақ енеді, бұл шамамен ферменттердің кеңейтілген альфа-спиральды аймағына сәйкес келеді.[11] Қатерлі ісік жасушаларында азурин комплекстері бар p53, оны тұрақтандыру және E3-пен байланысудың алдын алу уиквитин лигаздары, ол басқаша түрде ақуызды жою үшін байланыстырады және белгілейді.[12] Төрт азурин молекуласы әрбір р53 мономерін жоғары жақындығымен байланыстырады.[12] Р53 / азурин кешені ядроға өтеді, онда р53 проапоптотикалық гендердің транскрипциясын реттейді Бакс және Noxa.[12] Р53 сонымен қатар ісік жасушаларының одан әрі өсуіне жол бермей, жасушалық цикл тежегіштерінің экспрессиясын белсендіреді G1 немесе S фазасы.[12] Бұл жол азуриннің ісікке қарсы іс-әрекетінде маңызды рөл атқарса да, азурин мен р53 арасындағы өзара әрекеттесудің егжей-тегжейлері жақсы түсінілмеген.
Америка Құрама Штаттарындағы І фазалық клиникалық сынақ азуриннің р28 аминқышқылдық фрагментімен өңделген он бес сатылы онкологиялық науқастарда ісіктің регрессиясының ішінара және толық әсерін көрсетті.[13] P28 фрагменті бар тағы бір I кезеңдегі сынақ азуриннің ми ісіктері бар педиатриялық науқастарға терапиялық әсерін көрсетті; кейіннен USFDA p28-ді жетім дәрілік зат ретінде тағайындауды мақұлдады глиома.[14]
Азуриннің басқа домендері жасуша бетінің рецепторымен байланысу арқылы қатерлі ісікке қарсы белсенділікті көрсете алады тирозинкиназалар мысалы, индукциялайтын EphB2 рецепторлары ангиогенез қатерлі ісік жасушаларында.[14] Бұл азуриннің терапиялық әсерін көрсететін тағы бір механизм.
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ De Rienzo F, Gabdoulline RR, Menziani MC, Wade RC (тамыз 2000). «Көк мыс ақуыздары: олардың молекулалық өзара әрекеттесу қасиеттерін салыстырмалы талдау». Ақуыздар туралы ғылым. 9 (8): 1439–54. дои:10.1110 / ps.9.8.1439. PMC 2144732. PMID 10975566.
- ^ Yamada T, Goto M, Punj V, Zaborina O, Kimbara K, Das Gupta TK, Chakrabarty AM (желтоқсан 2002). «Бактериялы-тотықсыздандырғыш белок азурин J774 макрофагтарында апоптозды ісік супрессоры р53 күрделі қалыптастыру және тұрақтандыру арқылы тудырады». Инфекция және иммунитет. 70 (12): 7054–62. дои:10.1128 / IAI.70.12.7054-7062.2002. PMC 133031. PMID 12438386.
- ^ van den Bosch M, Swart M, Snijders JG, Berendsen HJ, Mark AE, Oostenbrink C, van Gunsteren WF, Canters GW (сәуір, 2005). «Азурин ақуызының және кейбір мутанттардың тотығу-тотықсыздану потенциалын есептеу». ChemBioChem. 6 (4): 738–46. дои:10.1002 / cbic.200400244. PMID 15747387.
- ^ а б Arcangeli C, Bizzarri AR, Cannistraro S (сәуір 1999). «Мыс азуриннің ұзақ мерзімді молекулалық динамикасын модельдеу: құрылымы, динамикасы және функционалдығы». Биофизикалық химия. 78 (3): 247–57. дои:10.1016 / S0301-4622 (99) 00029-0. PMID 17030312.
- ^ а б c г. e f ж Inoue T, Nishio N, Suzuki S, Kataoka K, Kohzuma T, Kai Y (маусым 1999). «Ахромобактер циклокласттарынан тотыққан және тотықсызданған псевдоазуриндердің кристалдық құрылымын анықтау. Қашықтықтан гистидин кезінде сутегі байланысын қайта құра отырып, мыс учаскесінің тотықсыздану формасында қозғалысы». Биологиялық химия журналы. 274 (25): 17845–52. дои:10.1074 / jbc.274.25.17845. PMID 10364229.
- ^ van de Kamp M, Silvestrini MC, Brunori M, Van Beeumen J, Hali FC, Canters GW (қараша 1990). «Азуриннің гидрофобты патчын цитохром С551 және нитрит редуктазы бар электронды беру реакцияларына қосу». Еуропалық биохимия журналы. 194 (1): 109–18. дои:10.1111 / j.1432-1033.1990.tb19434.x. PMID 2174771.
- ^ Opella SJ, DeSilva TM, Veglia G (сәуір 2002). «Металды байланыстыратын тізбектердің құрылымдық биологиясы». Химиялық биологиядағы қазіргі пікір. 6 (2): 217–23. дои:10.1016 / S1367-5931 (02) 00314-9. PMID 12039007.
- ^ а б c г. McLaughlin MP, Retegan M, Bill E, Payne TM, Shafaat HS, Peña S, Sudhamsu J, Ensign AA, Crane BR, Neese F, Holland PL (желтоқсан 2012). «Азурин кішігірім молекулалы байланыстыратын қалтасымен төмен координаталы темір емес учаске үшін ақуыздық тірек ретінде». Американдық химия қоғамының журналы. 134 (48): 19746–57. дои:10.1021 / ja308346b. PMC 3515693. PMID 23167247.
- ^ Vijgenboom E, Busch JE, Canters GW (қыркүйек 1997). «In vivo зерттеулерінде азуриннің Pseudomonas aeruginosa-да денитрификациядағы міндетті рөлі жоққа шығарылып, азу экспрессиясының rpoS пен ANR бақылауында болатындығы көрсетілген». Микробиология. 143 (9): 2853–63. дои:10.1099/00221287-143-9-2853. PMID 9308169.
- ^ Dodd FE, Hasnain SS, Hunter WN, Avraham ZH, Debenham M, Kanzler H, Eldridge M, Eady RR, Ambler RP, Smith BE (тамыз 1995). «Alcaligenes ксилозоксидандарындағы (NCIMB 11015) екі азуриннің дәлелі: нитрит редуктазасына электронды донорлар». Биохимия. 34 (32): 10180–6. дои:10.1021 / bi00032a011. PMID 7640272.
- ^ а б c Бернардес Н, Рибейро А.С., Серука Р, Паредес Дж, Фиалхо AM (наурыз 2011). «Бактерияларға арналған белок азурині емделмейтін сүт безі қатерлі ісігін емдеуге арналған жаңа дәрі-дәрмек ретінде». 1-ші португалдық биомедициналық инженерлік кездесу: 1–4. дои:10.1109 / ENBENG.2011.6026047. ISBN 978-1-4577-0522-9.
- ^ а б c г. Гао М, Чжоу Дж, Су З, Хуанг Ю (желтоқсан 2017). «Бактерияларға арналған купредоксин азурин ұялы сигнал беру желілерін ұрлайды: ақуыз-ақуыздың өзара әрекеттесуі және қатерлі ісік терапиясы». Ақуыздар туралы ғылым. 26 (12): 2334–2341. дои:10.1002 / pro.3310. PMC 5699490. PMID 28960574.
- ^ Warso MA, Richards JM, Mehta D, Christov K, Seffeff C, Rae Bressler L, Yamada T, Majumdar D, Kennedy SA, Beattie CW, Das Gupta TK (наурыз 2013). «І дәрежелі бірінші адамға, бірінші фазадағы р28 сынамасы, қатты қатты ісіктері бар науқастардағы р53 ебвицинациясының HDM2 емес пептидті ингибиторы». Британдық қатерлі ісік журналы. 108 (5): 1061–70. дои:10.1038 / bjc.2013.74. PMC 3619084. PMID 23449360.
- ^ а б Чаудхари А, Махфуз М, Фиалхо А.М., Ямада Т, Гранжа А.Т., Чжу Ю, Хашимото В, Шларб-Ридли Б, Чо В, Дас Гупта Т.К., Чакрабарти AM (ақпан 2007). «Купредоксин-қатерлі ісіктің өзара байланысы: азуринді EphB2-мен байланыстыру, EphB2 тирозинфосфорлануына араласу және қатерлі ісіктің өсуін тежеу». Биохимия. 46 (7): 1799–810. дои:10.1021 / bi061661x. PMID 17249693.
