Актинді индукциялайтын ақуыз - Actin assembly-inducing protein - Wikipedia
| Актинді индукциялайтын ақуыз | |||||||
|---|---|---|---|---|---|---|---|
 EVH1 домен-ActA пептидтік кешені | |||||||
| Идентификаторлар | |||||||
| Таңба | Акт | ||||||
| NCBI гені | 2798121 | ||||||
| UniProt | P33379 | ||||||
| |||||||
The Актинді индукциялайтын ақуыз (Акт) Бұл ақуыз кодталған және пайдаланылған Листерия моноцитогендері өзін сүтқоректілердің иесі жасушасы арқылы қозғау. АктА - мембраналық аймақты қамтитын бактериалды беткі белок.[1] Сүтқоректілер жасушасында ActA бактериялары өзара әрекеттеседі Arp2 / 3 кешені және актин бактерия бетінде актинді кометаның құйрығын тудыратын актин полимеризациясын тудыратын мономерлер. ActA кодтайтын ген аталады актА немесе prtB.[2]
Кіріспе
Тезірек Моноцитогендер бактерияларды адамдар жұтады, олар ішке енеді ішек эпителийі жасушалар және олардың ішкі вакуольінен тез құтылуға тырысады.[3][4] Цитозолда олар ActA ақуызының көмегімен өз бетінде актинді полимерлей бастайды. АктА басқа бактериялық факторлар болмаған кезде бактериялардың қозғалғыштығын қозғау үшін тек қажет емес, сонымен қатар жеткілікті екендігі көрсетілген.[5]
Ашу
ActA талдау арқылы анықталды лецитиназа - теріс Тн917 лак Листерия фенотипінің мутанттары, олар клеткадан жасушаға тарай алмады. Бұл мутантты бактериялар фагосомалардан жабайы типтегі бактериялар сияқты тиімді түрде қашып, жұқтырылған жасушаларда көбейген, бірақ олар жабайы типтегі бактериялар сияқты актинмен қоршалмаған. Әрі қарай талдау көрсеткендей, Тн917 лак енгізілген болатын актА, операның екінші гені. Осы операның үшінші гені, plcB, кодтайды Моноцитогендер лецитиназа. Ма екенін анықтау үшін актА өзі, plcB немесе актинді жинауға басқа ко-транскрипцияланған төменгі ағынды аймақтар қатысады, тиісті гендерде мутациялар түзілді. Осыдан басқа барлық мутанттар актА мутанттар F-актинмен және жасуша жасушаларының таралуымен байланысты жабайы типке ұқсас болды. Толықтыру актА жабайы типтегі фенотип қалпына келтірілді актА мутанттар.[1]
Функция

Акт - бұл мимика ретінде әрекет ететін ақуыз Вискотт-Олдрич синдромының ақуызы (WASP), қабылдаушы жасушаларда болатын ядролауды көтермелейтін фактор (NPF). Сүтқоректілер клеткасындағы NPF жиналып, бұрыннан барымен байланысады актинге байланысты 2 және 3 ақуыздар кешені (Arp2 / 3 кешені) және Arp2 / 3 кешенінің активтендіруші конформациялық өзгерісін тудырады.[6] Осы конформациялық өзгеріске байланысты NPF жаңа актин жіпін 70 ° бұрышта полимеризациялауды бастайды, бұл қозғалмалы жасушалардың жетекші жиегіне тән Y-тармақталған актин құрылымдарына әкеледі. ActA бактерияның ескі полюсіне локализацияланып, бактерия жасушасының мембранасын да, жасуша қабырғасын да қамтиды, бүйірлік диффузия тежеледі; осылайша ActA бактериялардың бетіне поляризацияланған және якорьді түрде локализацияланған. Демек, актинді полимерлеу тек осы аймақта бактерия бетінен басталады.[7] ActA экспрессиясы тек сүтқоректілердің иесі жасушасына енгеннен кейін пайда болады.[8]
Актин жіпшесінің құрамы сүтқоректілер иесі цитоплазмасындағы бактерияны алға итермелейтін күш тудырады. Үздіксіз актинді полимерлеу цитоплазмадағы қозғалғыштық үшін және тіпті іргелес жасушалардың инфекциясы үшін жеткілікті.[9]
Зерттеу
Жаңа мәліметтер ActA-ның вакуольді бұзылуда да рөл атқаратындығын көрсетеді. Вакуольді өткізіп алу кезінде ActA-ның жойылу мутанты ақаулы болды. Қышқыл аймақтың N-терминалының (32-42) 11 аминқышқылының созылуының бұзылуы үшін маңызды екендігі көрсетілген фагосома.[10]
Құрылым
Ақуыздың алғашқы өнімі актА ген 639 амин қышқылынан тұрады және сигнал пептидін (бірінші N-терминалы 29 амин қышқылы) және АктА тізбегін (C-терминалы 610 амин қышқылдары) қамтиды. Сондықтан жетілген ActA ақуызының кезектілігі 610 амин қышқылынан тұрады. АктА молекулалық массасы 70 349 Да құрайды және ол беткі белок болып табылады.[1][2]
ActA - бұл өздігінен ашылмаған ақуыз, оны үш функционалды салаға бөлуге болады (2-сурет):[1][11][12]
- Жоғары зарядталған N-терминал домені: амин қышқылының қалдықтары 1-234
- Пролинге бай қайталанатын орталық домен: аминқышқылдарының қалдықтары 235-394
- Трансмембраналық домені бар C-терминал домені: аминқышқылдарының қалдықтары 395-610
N-терминал домені
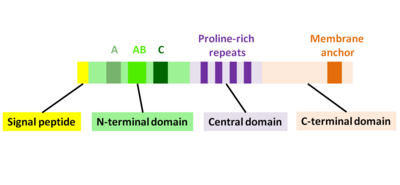
N-терминалдың алғашқы 156 амин қышқылдары үш аймақтан тұрады[10][13] (Cурет 2):
- Қышқыл қалдықтарының созылған А-аймағы: 32-45
- АВ-аймақ, актин мономерімен байланысатын аймақ: 59-102
- С-аймақ, кофилин гомологиясының реттілігі: 145-156
Актиннің N-терминалды бөлігі актин полимеризациясында маңызды рөл атқарады.[14] Доменде эукариоттық WASP отбасында бар консенсус элементтері бар, олар актин мономерімен байланысатын аймақ, сондай-ақ Arp2 / 3 байланыстыратын С (орталық немесе кофилин гомологиясы) және А (қышқыл) аймағын қамтиды.[7] ActA мономерін байланыстыратын аймақ WASP-Homology-2 (WH2) немесе V домені сияқты функционалды қасиеттерге ие, бірақ реттілігімен ерекшеленеді.[15] Осылайша, WASP-отбасылық NPF-де домендер реті WH2, одан кейін С, содан кейін А болады, бұл Акт-та жоқ.
Орталық домен
АктА-ның пролинге бай орталық ауданы бактериялардың моторикасын тиімді ету үшін өте маңызды. FPPPP немесе FPPIP мотивтерін қамтитын пролинге бай төрт қайталау бар. Бұл аймақтар иесінің жасушалары цитоскелет ақуызын имитациялайды зыксин, винкулин және палладин, байланыстыратыны белгілі фокальды адгезиялар немесе стресс талшықтары.[16] Вазодилататормен ынталандырылған фосфопротеин (VASP ) Ena / VASP homology 1 домені арқылы байланыса алады (EVH1 домені ) орталық пролинге бай аймаққа және шақырылушыларға профилин, актин мономерімен байланысатын ақуыз, ол өзі актин жіптерінің тікенді ұштарында полимеризацияға ықпал етеді. Сонымен қатар, VASP өзара әрекеттесетін сияқты F-актин бактерияның құйрықпен байланысын қамтамасыз ететін EVH2 карбокси-терминалы домені арқылы.[17] Бұл мәлімдемені ActA бірнеше Ena / VASP ақуыздарын бір уақытта байланыстыра алатындығына және ActA мен Ena / VASP арасында жоғары жақындығына ие екендігіне негізделген. VASP in vitro жиіліктегі актин-Y-тармақтарын төмендететіні көрсетілген және осылайша кометаның құйрықтарында параллель тураланған жіптердің үлесін арттырады.[18][19]
C-терминал домені
ActA-ның C-терминалының доменінде бактерия қабықшасындағы ақуызды бекітетін гидрофобты аймақ бар.[20][21][22]
Қысқаша айтқанда, сонымен қатар
- актинмен байланыстыратын аймақта реттілік гомологиясының болмауы және
- WASP-отбасылық NPF (V (WH2) -C-A) үшін тән ARP2 / 3 активтендіруші домендерінің кезектесуі,
- ActA мен хост NPF-тердің арасындағы үлкен айырмашылық, ActA-да Rho отбасылық GTPases сияқты реттеуші ақуыздармен байланысатын элементтердің болмауында. ActA мен хост NPF арасындағы бұл құрылымдық айырмашылық пайдалы болуы мүмкін Моноцитогендер және оның патогенезі, өйткені актиннің ядролық белсенділігі Моноцитогендер хосттың реттелуіне тәуелді емес.[7]
Аналогтар
WASP / N-WASP, функционалды түрде ActA имитациялайды, эукариоттарда жоғары деңгейде сақталады. Бұл актин-цитоскелеттің маңызды ұйымдастырушысы және эндоцитоз және жасушалардың моторикасы сияқты процестер үшін өте маңызды. Белсендірілген Ccc42, Rho-отбасылық шағын GTPase, WASP / N-WASP тез актин полимеризациясына әкелетін Arp2 / 3 кешенін белсендіреді.[23]
Басқа қоздырғыштардың актинге негізделген моторикасы
Жылы Шигелла IcsA ақуызы белсенділенеді N-WASP, оны жұқтырмаған сүтқоректілер жасушаларында GTPase Cdc42 белсендіреді. Белсенді N-WASP / WASP Arp2 / 3 кешенін белсендіру арқылы актин полимеризациясына әкеледі. Керісінше, Листерия ActA ақуызы тікелей Arp2 / 3 кешенімен әрекеттеседі және белсендіреді.[7]
The Риккетсия RickA ақуызы Arp2 / 3 кешенін WASP тәрізді түрде белсендіре алады. Айырмашылығы Листерия, актин жіпшелері ұзын, тармақталмаған параллель байламдарда орналасқан. Arp2 / 3 кешені бактериялар бетіне жақын жерде ғана локализацияланған, сондықтан Arp2 / 3 комплексінен тәуелсіз созылу жиірек болады деп болжануда.[16]
Жылы Бурхолдерия псевдомаллей BimA in vitro актин полимеризациясын бастайды. Бұл бактерияның жасушаішілік миграциясы Arp2 / 3 кешеніне тәуелсіз жұмыс істейді деп болжануда.[16]
Сондай-ақ қараңыз
Әдебиеттер тізімі
- ^ а б c г. Kocks C, Gouin E, Tabouret M, Berche P, Ohayon H, Cossart P (ақпан 1992). «L. monocytogenes индукцияланған актинді жинау үшін актА генінің өнімі, беткі белок қажет». Ұяшық. 68 (3): 521–31. дои:10.1016 / 0092-8674 (92) 90188-I. PMID 1739966.
- ^ а б Uniprot P33379
- ^ Cossart P, Sansonetti PJ (сәуір 2004). «Бактериялық инвазия: энтероинвазивті патогендердің парадигмалары». Ғылым. 304 (5668): 242–8. дои:10.1126 / ғылым.1090124. PMID 15073367.
- ^ Cossart P, Pizarro-Cerdá J, Lecuit M (қаңтар 2003). «Listeria monocytogenes-тің сүтқоректілер жасушаларын басып алуы: жасушалық функцияларды бұзу үшін функционалды мимика». Жасуша биологиясының тенденциялары. 13 (1): 23–31. дои:10.1016 / S0962-8924 (02) 00006-5. PMID 12480337.
- ^ Zigmond SH (ақпан 2004). «Актин жіпшелерінің форминнің әсерінен ядролануы». Жасуша биологиясындағы қазіргі пікір. 16 (1): 99–105. дои:10.1016 / j.ceb.2003.10.019. PMID 15037312.
- ^ Goley ED, Rodenbusch SE, Martin AC, Welch MD (қазан 2004). «Arp2 / 3 комплексіндегі сыни конформациялық өзгерістер нуклеотид пен ядролаудың ықпал етуші факторымен индукцияланады». Молекулалық жасуша. 16 (2): 269–79. дои:10.1016 / j.molcel.2004.09.018. PMID 15494313.
- ^ а б c г. Gouin E, Welch MD, Cossart P (ақпан 2005). «Жасушаішілік қоздырғыштардың актинге негізделген қозғалғыштығы». Микробиологиядағы қазіргі пікір. 8 (1): 35–45. дои:10.1016 / j.mib.2004.12.013. PMID 15694855.
- ^ Рафельски С.М., Theriot JA (ақпан 2006). «Listeria monocytogenes беткі белок ActA поляризациясының механизмі». Молекулалық микробиология. 59 (4): 1262–79. дои:10.1111 / j.1365-2958.2006.05025.x. PMC 1413586. PMID 16430699.
- ^ Голдберг Мб (желтоқсан 2001). «Жасушаішілік микробтық патогендердің актинге негізделген қозғалғыштығы». Микробиология және молекулалық биологияға шолу. 65 (4): 595–626. дои:10.1128 / MMBR.65.4.595-626.2001. PMC 99042. PMID 11729265.
- ^ а б Пуссин М.А., Goldfine H (қаңтар, 2010). «Listeria monocytogenes фагосомасының жетілуіне ActA қатысуы туралы дәлелдер». Жасушаларды зерттеу. 20 (1): 109–12. дои:10.1038 / cr.2009.142. PMC 2802179. PMID 20029388.
- ^ Ireton K, Cossart P (1997). «Listeria monocytogenes-тің енуі және қозғалуы кезінде қоздырғышпен әрекеттесу». Жыл сайынғы генетикаға шолу. 31: 113–38. дои:10.1146 / annurev.genet.31.1.113. PMID 9442892.
- ^ Төменгі колонтитул, Мэттью Дж .; Лио, Джон К .; Терриот, Джули А. (2008-08-29). «Listeria monocytogenes ActA, табиғи түрде ашылмаған ақуыз, F-актиндік жиынды димеризациясыз жақсартады». Биологиялық химия журналы. 283 (35): 23852–23862. дои:10.1074 / jbc.M803448200. ISSN 0021-9258. PMC 2527104. PMID 18577520.
- ^ Welch, Мэттью Д. (2007). «Listeria моноцитогендерінің актинге негізделген қозғалғыштығы және жасушадан жасушаға таралуы». Голдфайнда, Ховард; Шен, Хао (ред.). Листерия моноцитогендері: патогенезі және иесінің реакциясы. Нью-Йорк: Спрингер. 197–223 беттер. дои:10.1007/978-0-387-49376-3_10. ISBN 978-0-387-49373-2.
- ^ Welch MD, Rosenblatt J, Skoble J, Portnoy DA, Mitchison TJ (шілде 1998). «Адамның Arp2 / 3 кешені мен Listeria monocytogenes ActA ақуызының актинді жіп тәрізді ядроларындағы өзара әрекеттесуі». Ғылым. 281 (5373): 105–8. дои:10.1126 / ғылым.281.5373.105. PMID 9651243.
- ^ Залевский Дж, Григорова I, Муллинс Р.Д. (2001 ж. Ақпан). «Listeria acta ақуызымен Arp2 / 3 кешенін активтендіру. Acta екі актин мономерін және Arp2 / 3 кешенінің үш суббірлігін байланыстырады». Биологиялық химия журналы. 276 (5): 3468–75. дои:10.1074 / jbc.M006407200. PMID 11029465.
- ^ а б c Lambrechts A, Gevaert K, Cossart P, Vandekerckhove J, Van Troys M (мамыр 2008). «Listeria кометасының құйрықтары: жұмыс кезінде актин негізіндегі қозғалғыштық техникасы». Жасуша биологиясының тенденциялары. 18 (5): 220–7. дои:10.1016 / j.tb.2008.03.001. PMID 18396046.
- ^ Лоран V, Лойзель Т.П., Харбек Б, және т.б. (Наурыз 1999). «Lista monocytogenes-тің актин негізіндегі қозғалғыштығындағы Эна / VASP отбасы ақуыздарының рөлі». Жасуша биологиясының журналы. 144 (6): 1245–58. дои:10.1083 / jcb.144.6.1245. PMC 2150578. PMID 10087267.
- ^ Skoble J, Auerbuch V, Goley ED, Welch MD, Portnoy DA (қазан 2001). «Arp2 / 3 күрделі-делдалды актиннің ядролануы, актин тармағының түзілуі және Listeria monocytogenes қозғалғыштығындағы VASP-тің маңызды рөлі». Жасуша биологиясының журналы. 155 (1): 89–100. дои:10.1083 / jcb.200106061. PMC 2150787. PMID 11581288.
- ^ Аю Ж.Е., Свиткина Т.М., Краузе М және т.б. (Мамыр 2002). «Эна / VASP ақуыздары мен актин жіптерінің қақпағы арасындағы антагонизм фибробласттың қозғалғыштығын реттейді». Ұяшық. 109 (4): 509–21. дои:10.1016 / S0092-8674 (02) 00731-6. hdl:1721.1/83477. PMID 12086607.
- ^ Васкес-Боланд Дж.А., Кокс С, Драмси С және т.б. (Қаңтар 1992). «Listeria моноцитогендерінің лецитиназа оперонының нуклеотидтік реттілігі және летитиназаның жасушадан жасушаға таралуындағы рөлі». Инфекция және иммунитет. 60 (1): 219–30. PMC 257526. PMID 1309513.
- ^ Доманн Е, Велланд Дж, Рохде М және т.б. (Мамыр 1992). «Винкулиннің пролинге бай аймағына гомологиямен иесінің жасушаларының микрофиламенттерімен өзара әрекеттесуі үшін қажет жаңа листериа моноцитогендеріндегі бактериялық вируленттілік гені». EMBO журналы. 11 (5): 1981–90. дои:10.1002 / j.1460-2075.1992.tb05252.x. PMC 556658. PMID 1582425.
- ^ Kocks C, Hellio R, Gounon P, Ohayon H, Cossart P (шілде 1993). «Listeria monocytogenes беткі белок ActA-ның поляризациялық таралуы директивті актин жиналған жерде». Cell Science журналы. 105 (3): 699–710. PMID 8408297.
- ^ Курису С, Такенава Т (2009). «WASP және WAVE отбасылық ақуыздар». Геном биологиясы. 10 (6): 226. дои:10.1186 / gb-2009-10-6-226. PMC 2718491. PMID 19589182.
Сыртқы сілтемелер
- YouTube бейнесі бастап Табиғат, Листерия моноцитогендері [2:00–4:12]
